バイオ後続品
- バイオ後続品とは?
- バイオ後続品の対象は?
- 新有効成分含有医薬品、バイオ後続品、ジェネリック医薬品の比較
- バイオ後続品の品質
- バイオ後続品の名称
- 日米欧で承認されているバイオ後続品(バイオシミラー)及び先行バイオ医薬品
- バイオ後続品に関する指針・通知
- バイオ後続品に関する情報サイト
バイオ後続品とは?
平成21年3月4日「バイオ後続品の承認申請について」が通知され、医薬品申請における新たな区分としてバイオ後続品が追加されました(薬食審査発第0304004号)。これにより、バイオ後続品は、新有効成分含有医薬品やジェネリック医薬品とは区分して取り扱われることになりました。
さらに同じ日、「バイオ後続品の品質・安全性・有効性確保のための指針」が発出され、バイオ後続品の定義、対象範囲、及びバイオ後続品の品質・有効性・安全性確保に関する考え方などが示されました(薬食発第0304007号)。バイオ後続品とは、「国内で既に新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(先行バイオ医薬品)と同等/同質の品質、安全性及び有効性を有する医薬品として、異なる製造販売業者により開発される医薬品」のことをさします。一般に、品質、安全性及び有効性について、先行バイオ医薬品との比較から得られた同等性/同質性を示すデータ等に基づき開発することができます。
バイオ後続品の対象は?
バイオ後続品の対象
- 微生物や培養細胞を用いて生産され、高度に精製され、一連の適切な分析方法により特性解析ができる遺伝子組換えタンパク質(単純タンパク質及び糖タンパク質を含む)、ポリペプチド及びそれらの誘導体並びにそれらを構成成分とする医薬品(例えば、抱合体)。
- 細胞培養技術を用いて生産される非組換えタンパク質医薬品、あるいは組織及び体液から分離されるタンパク質やポリペプチドのような上記の範疇以外の医薬品であっても、高度に精製され、品質特性解析可能な医薬品には適用できる場合がある。
バイオ後続品の対象外
- 従来型ワクチンや、ヘパリンなどの多糖類。
- わが国において審査経験/使用実績のない製品。
- バイオ後続品に対するバイオ後続品 注2。
(注2:その後発出された質疑応答集(Q&A)では、将来的な可能性としてはあり得ることが示されている)
新有効成分含有医薬品、バイオ後続品、後発医薬品(ジェネリック医薬品)の比較
| 新有効成分含有医薬品 | バイオ後続品 | 後発医薬品 | |
|---|---|---|---|
| 定 義 | 既承認医薬品及び日本薬局方に定められている医薬品のいずれにも有効成分として含有されていない成分を有効成分として含有する医薬品。 | 新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(先行バイオ医薬品)と同等/同質の品質、安全性及び有効性を有する医薬品。注1) | 先発医薬品と同一の有効成分を同一量含み、同一経路から投与する製剤で、効能・効果、用法・用量が原則的に同一であり、先発医薬品と同等の臨床効果・作用が得られる医薬品。注2) |
| 申請時期 | 新 規 | 先行バイオ医薬品の特許期間、再審査期間終了後 | 先発医薬品の特許期間、再審査期間終了後 |
注1)バイオ後続品の品質・安全性・有効性確保のための指針
注2)ジェネリック医薬品への疑問に答えます ~ジェネリック医薬品 Q&A~
バイオ後続品の品質
バイオ後続品は、先行バイオ医薬品開発メーカーとは異なるメーカーにより、先行バイオ医薬品とは異なる細胞基材、遺伝子発現構成体、培養・精製工程、製剤化工程を用いて製造されます。そのために、① 構造・組成、② 物理的化学的性質、③ 生物学的性質、④ 免疫学的性質、⑤ 不純物(目的物質由来不純物、宿主由来タンパク質や培養液などに由来する工程由来不純物、ウイルス等混入汚染物質等)などについて明らかにすることが求められます。また、先行バイオ医薬品との比較試験(糖タンパク質における糖鎖プロファイルや、目的物質関連物質及び不純物プロファイルの比較等)を行います。さらに、品質特性を充分に理解した上で、工程管理試験、規格及び試験法など、管理方法を設定する必要があります。
バイオ後続品の名称
バイオ後続品の一般的名称及び販売名は、先行バイオ医薬品及び同一品を先行バイオ医薬品とする他のバイオ後続品と容易に区別できるように付けられます(薬食審査発第0922001号通知及び薬食審査発0214第1号)。
バイオ後続品の一般的名称は、先行バイオ医薬品の一般的名称(遺伝子組換えに係る記載を除く)の末尾に「後続1 (2, 3,…)」を角括弧書きで追加します。
バイオ後続品の販売名については、薬食審査発第0922001号通知に準じ、先行バイオ医薬品の一般的名称(「遺伝子組換え」は省略)の末尾に、バイオ後続品であることを示すために「BS」と記載します。これに、剤形、含量及び会社名(屋号等)を付すことが原則です。
〈記載例1〉
インスリン キクンデス(遺伝子組換え)のバイオ後続品として衛研製薬が製造する注射液。
先行品 一般的名称:インスリン キクンデス(遺伝子組換え)
後続品 一般的名称:インスリン キクンデス(遺伝子組換え)[インスリン キクンデス後続1]
後続品 販 売 名:インスリン キクンデスBS注射液100単位/mL「衛研」
〈記載例2〉
フォリトロピン ベータ(遺伝子組換え)の2つめのバイオ後続品として衛研製薬が製造する注射液。
先行品 一般的名称:フォリトロピン ベータ(遺伝子組換え)
後続品 一般的名称:フォリトロピン デルタ(遺伝子組換え)[フォリトロピン ベータ後続2]
後続品 販 売 名:フォリトロピン ベータBS注射液150「衛研」
日本で承認されたバイオ後続品
| 先行バイオ 医薬品商品名 |
バイオ後続品 | ||
|---|---|---|---|
| 一般名 (注1)(注2) | 商品名 | 承認年 | |
| ジェノトロピン | ソマトロピン | ソマトロピンBS皮下注「サンド」 | 2009 |
| ランタス | インスリン グラルギン [インスリン グラルギン後続1] | インスリン グラルギンBS注「リリー」 | 2014 |
| インスリン グラルギン [インスリン グラルギン後続2] | インスリン グラルギンBS注「FFP」 | 2016 | |
| ヒューマログ | インスリン リスプロ [インスリン リスプロ後続1] | インスリン リスプロBS注「サノフィ」 | 2020 |
| ノボラピッド | インスリン アスパルト [インスリン アスパルト後続1] | インスリン アスパルトBS注「サノフィ」 | 2021 |
| グラン | フィルグラスチム [フィルグラスチム後続1] | フィルグラスチムBS注「F」, *販売中止(2022年) |
2012 |
| フィルグラスチム [フィルグラスチム後続2] | フィルグラスチムBS注「NK」, *「テバ」から「NIG」に継承 *販売中止(2023年) |
2013 | |
*販売中止(2020年) |
|||
| ジーラスタ | ペグフィルグラスチム[ペグフィルグラスチム[後続1] | ペグフィルグラスチムBS皮下注「モチダ」,「ニプロ」 | 2023 | フォルテオ | テリパラチド[テリパラチド後続1] | テリパラチドBS皮下注「モチダ」 | 2019 |
| エスポー | エポエチン カッパ [エポエチン アルファ後続1] | エポエチン アルファBS注「JCR」 | 2010 |
| ネスプ | ダルベポエチン アルファ [ダルベポエチン アルファ後続1] | ダルベポエチン アルファBS注 「JCR」 | 2019 |
| ダルベポエチン アルファ [ダルベポエチン アルファ後続2] | ダルベポエチン アルファBS注「三和」 | 2019 | |
| ダルベポエチン アルファ [ダルベポエチン アルファ後続3] | ダルベポエチン アルファBS注射液「MYL」 | 2019 | |
| ファブラザイム | アガルシダーゼ ベータ [アガルシダーゼ ベータ後続1] | アガルシダーゼ ベータBS点滴静注「JCR」 | 2018 |
| レミケード | インフリキシマブ [インフリキシマブ後続1] | インフリキシマブBS点滴静注用「NK」,「CTH」 | 2014 |
| インフリキシマブ [インフリキシマブ後続2] | インフリキシマブBS点滴静注用「あゆみ」,「日医工」 | 2017 | |
| インフリキシマブ [インフリキシマブ後続3] | インフリキシマブBS点滴静注用「ファイザー」 | 2018 | |
| ヒュミラ | アダリムマブ [アダリムマブ後続1] | アダリムマブBS皮下注「FKB」 | 2020 |
| アダリムマブ [アダリムマブ後続2] | アダリムマブBS皮下注「第一三共」 | 2021 | |
| アダリムマブ [アダリムマブ後続3] | アダリムマブBS皮下注「MA」 | 2021 | |
| アダリムマブ [アダリムマブ後続4] | アダリムマブBS皮下注「CTNK」 | 2023 | |
| リツキサン | リツキシマブ [リツキシマブ後続1] | リツキシマブBS点滴静注「KHK」 | 2017 |
| リツキシマブ [リツキシマブ後続2] | リツキシマブBS点滴静注「ファイザー」 | 2019 | |
| ハーセプチン | トラスツズマブ [トラスツズマブ後続1] | トラスツズマブBS点滴静注用「NK」,「CTH」 | 2018 |
| トラスツズマブ [トラスツズマブ後続3] | トラスツズマブBS点滴静注用「ファイザー」 | 2018 | |
| アバスチン | ベバシズマブ [ベバシズマブ後続1] | ベバシズマブBS点滴静注「ファイザー」 | 2019 |
| ベバシズマブ [ベバシズマブ後続2] | ベバシズマブBS点滴静注 |
2019 | |
| ベバシズマブ [ベバシズマブ後続3] | ベバシズマブBS点滴静注「日医工」 | 2022 | |
| ベバシズマブ [ベバシズマブ後続4] | ベバシズマブBS点滴静注「CTNK」 | 2022 | |
| ステラーラ | ウステキヌマブ[ウステキヌマブ後続1] | ウステキヌマブBS皮下注「F」 | 2023 | ウステキヌマブ[ウステキヌマブ後続2] | ウステキヌマブBS皮下注「YD」 | 2024 | ウステキヌマブ[ウステキヌマブ後続3] | ウステキヌマブBS皮下注「CT」 | 2025 | ウステキヌマブ[ウステキヌマブ後続4] | ウステキヌマブBS皮下注「ニプロ」 | 2025 |
| ルセンティス | ラニビズマブ[ラニビズマブ後続1] | ラニビズマブBS硝子体内注射用「センジュ」 | 2021 |
| ランマーク | デノスマブ[デノスマブ後続1] | デノスマブBS皮下注「F」 | 2025 |
| シンポニー | ゴリムマブ[ゴリムマブ後続1] | ゴリムマブBS皮下注「F」 | 2025 |
| アクテムラ | トシリズマブ[トシリズマブ後続1] | トシリズマブBS皮下注,BS点滴静注「CT」 | 2025 |
| エンブレル | エタネルセプト[エタネルセプト後続1] | エタネルセプトBS皮下注,皮下注用「MA」 | 2018 |
| エタネルセプト[エタネルセプト後続2] | エタネルセプトBS皮下注「TY」,「日医工」 | 2019 | |
| アイリーア | アフリベルセプト[アフリベルセプト後続1] | アフリベルセプトBS硝子体内注射液「GRP」 | 2024 | アフリベルセプト[アフリベルセプト後続2] | アフリベルセプトBS硝子体内注射液「NIT」 | 2025 | アフリベルセプト[アフリベルセプト後続3] | アフリベルセプトBS硝子体内注射液「SCD」 | 2025 |
(注1)組換えタンパク質の一般名に含まれている "(遺伝子組換え)" は,省略して表記しています。
(注2)PMDAの「医療用医薬品 情報検索」サイトから、初回承認時の審査報告書を転載しています。
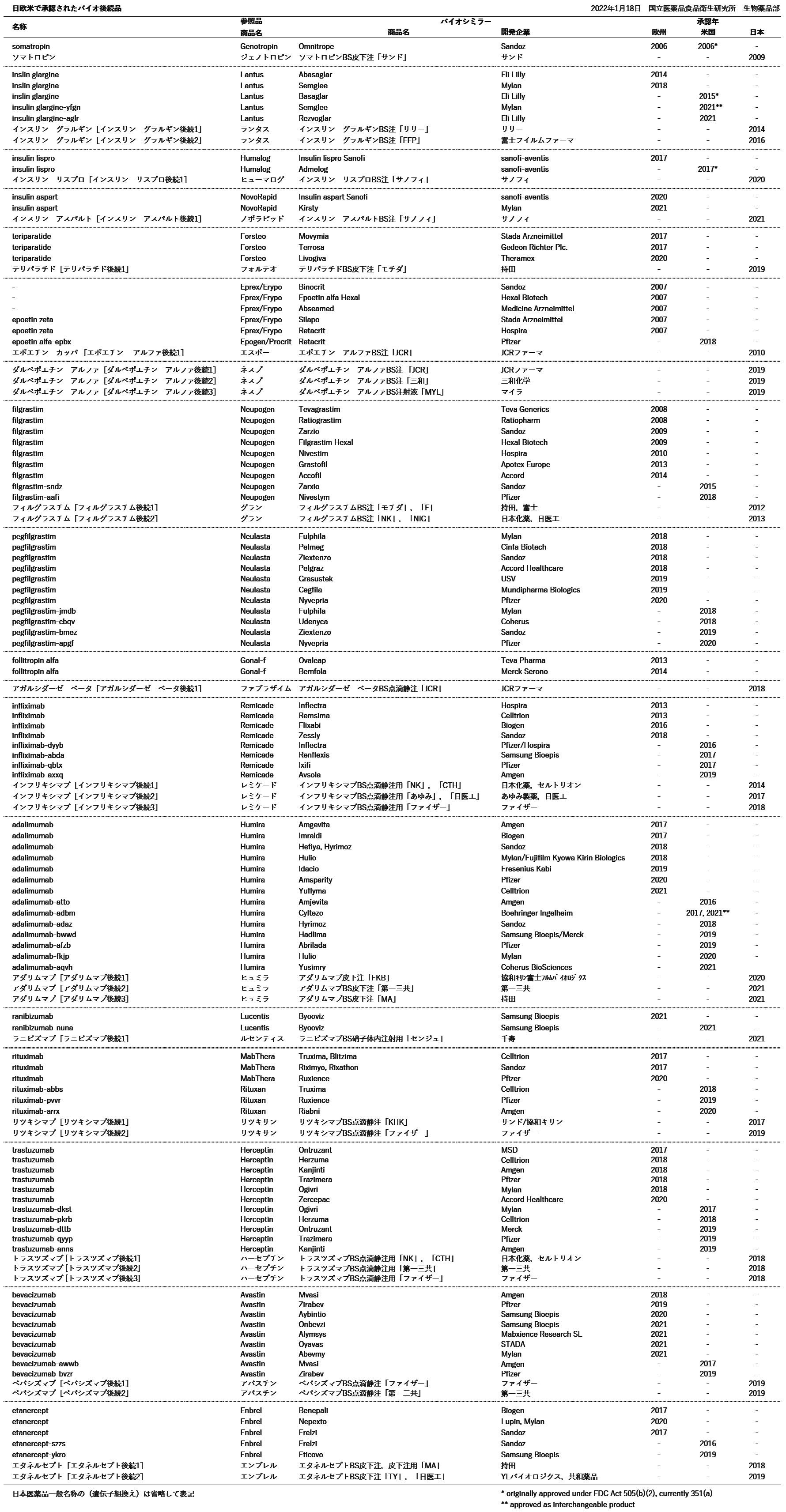
日米欧で承認されているバイオ後続品(バイオシミラー医薬品)及び先行バイオ医薬品
バイオ後続品に関する指針・通知
- バイオ後続品の品質・安全性・有効性確保のための指針
薬生薬審発0204 第1号(令和2年2月4日) - バイオ後続品の品質・安全性・有効性確保のための指針の英訳版について
事務連絡 厚生労働省医薬局医薬品審査管理課(令和6年3月12日) - バイオ後続品の品質・安全性・有効性確保のための指針に関する質疑応答集(Q&A)について
事務連絡 厚生労働省医薬局医薬品審査管理課(令和6年1月25日) - バイオ後続品の品質・安全性・有効性確保のための指針に関する質疑応答集(Q&A) の英訳版について
事務連絡 厚生労働省医薬局医薬品審査管理課(令和6年3月12日) - 「バイオ後続品の品質・安全性・有効性確保のための指針(改正案)」に関する意見募集の結果について
事務連絡 厚生労働省医薬・生活衛生局医薬品審査管理課(令和2年2月7日) - バイオ後続品に係る一般的名称及び販売名の取扱いについて
薬食審査発0214第1号(平成25年2月14日) - バイオ後続品の承認申請について
薬食発第0304004号(平成21年3月4日) - バイオ後続品の承認申請に際し留意すべき事項について
薬食審査発第0304015号(平成21年3月4日)
--------------------------------------------------------------------- - バイオ後続品の品質・安全性・有効性確保のための指針
薬食審査発第0304007号(平成21年3月4日) - バイオ後続品に係る一般的名称及び販売名の取扱いについて
薬食審査発第0304011号(平成21年3月4日) - バイオ後続品の品質・有効性・安全性確保のための指針(案)に関する意見公募に対して寄せられた御意見について
厚生労働省医薬食品局審査管理課(平成21年3月4日) - バイオ後続品の品質・有効性・安全性確保のための指針に関する質疑応答集(Q&A)について-1
事務連絡 厚生労働省医薬食品局審査管理課(平成21年7月21日) - バイオ後続品の品質・有効性・安全性確保のための指針に関する質疑応答集(Q&A)について-2
事務連絡 厚生労働省医薬食品局審査管理課(平成22年3月31日) - バイオ後続品の品質・有効性・安全性確保のための指針に関する質疑応答集(Q&A)について-3
事務連絡 厚生労働省医薬・生活衛生局審査管理課(平成27年12月15日) - バイオ後続品の品質・有効性・安全性確保のための指針に関する質疑応答集(Q&A)
事務連絡 厚生労働省医薬・生活衛生局医薬品審査管理課(令和2年2月4日) - バイオ後続品 (医薬品医療機器総合機構のウエブサイト)
- FDA Biosimilars Guidances (FDAのウエブサイト)
- EMA Biosimilar Guidelines (EMAのウエブサイト)
*参考:旧指針とその質疑応答集
