第二室
| 室長 | 齊藤 公亮 | Saito Kosuke |
| 主任研究官 | 橋本 晨(孫 雨晨) | Hashimoto Aki (Sun Yuchen) |
| 主任研究官 | 薄田 健史 | Susukida Takeshi |
| 研究補助員 | 石川 リカ | Ishikawa Rika |
| 研究補助員 | 樅山 利子 | Momiyama Toshiko |
業務紹介
医薬安全科学部第2室では医薬品の安全性に関するバイオマーカー開発、及びその知識・経験・技術を用いた関連研究業務をおこなっています。具体的な研究課題と内容は下記の通りです(令和4年11月現在)。
- 「薬剤性間質性肺炎・重症薬疹に関するバイオマーカー候補の適格性確認と規制要件案の作成に関する研究」(齊藤・荒川・孫)
昨年度までに実施していた研究課題(官民共同による重篤副作用バイオマーカー開発)において同定した有望なバイオマーカー候補について、
1) 対象5種のバイオマーカーに関するPMDAの適格性確認(使用目的、適用可能範囲等の明確化とその公表)を受けること、
2) 副作用バイオマーカーに関する規制要件案、RNAバイオマーカーの分析法バリデーションの留意点文書を作成すること
を目的としています。当室では下記の3分担課題を担当しています。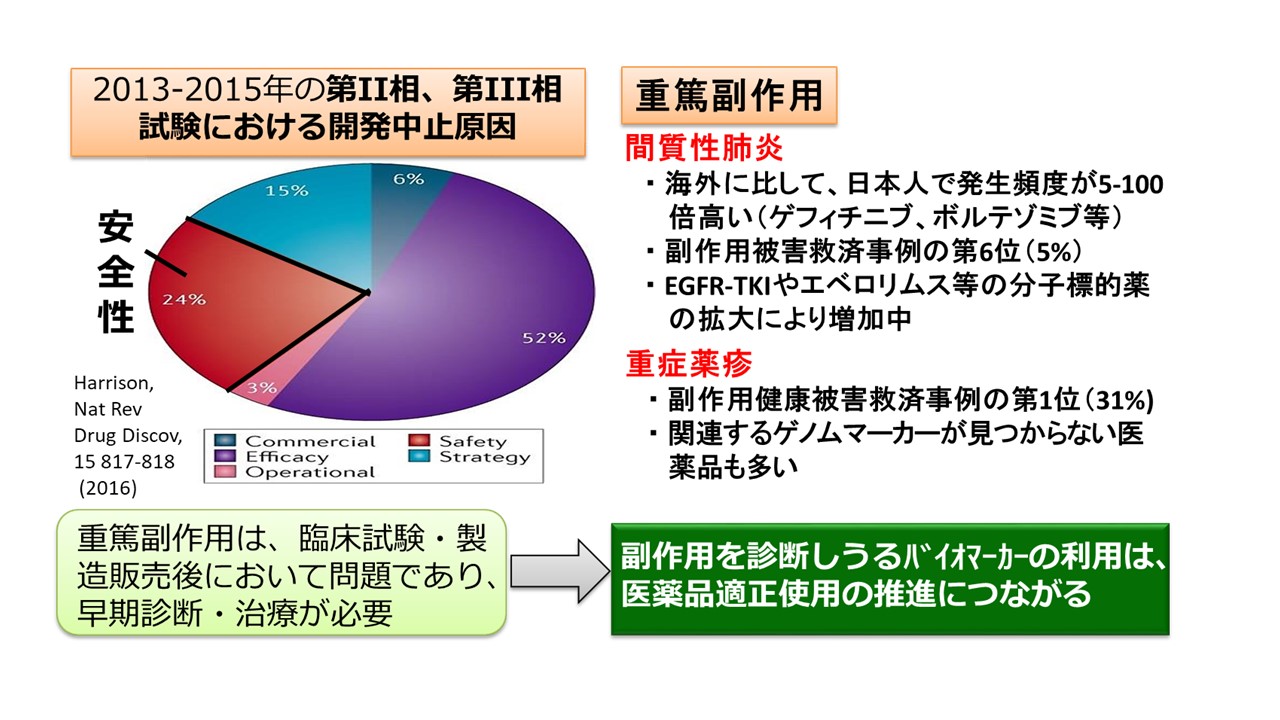
- (荒川)
- 薬剤性間質性肺炎に関する代謝物バイオマーカー候補の適格性確認(齊藤・孫)
- RNAバイオマーカーに関する分析法バリデーションの検討(孫)
研究課題(官民共同による重篤副作用バイオマーカー開発)において、重篤副作用の代謝物バイオマーカーの網羅的探索を担当し、薬剤性間質性肺炎について、有望なマーカー候補を2種同定しました。そこで、その2種のバイオマーカーに対して、分析法バリデーションを行った測定系を用いて、患者試料を用いた臨床的バリデーションを行います。また、これら2種のバイオマーカーに関し、細胞・組織における変動要因の同定やゲノム解析に基づき、副作用機序との関連性の解明を通して、最終的にデータを基にしてPMDAによる適格性確認を受けることを目的としています。
なお、研究課題(官民共同による重篤副作用バイオマーカー開発)では代謝物の網羅的探索によって、薬剤性間質性肺炎だけでなく、薬物性肝障害、及び重症薬疹のバイオマーカー候補を数多く同定しています。近年、医薬品の臨床開発促進や適切利用の目的で、種々のタンパク質や低分子代謝物等の生体分子がバイオマーカーとして使用されています。これら生体分子の生体試料中濃度の分析については、これまでに米国や欧州の規制機関より分析法バリデーションに関する留意点文書が公表されているものの、生体中の核酸分子を対象とした分析法に関する規制ガイドラインは未だ公表されていません。そこで、本研究では本邦におけるRNAマーカー(マイクロRNA等)の体外診断薬の開発促進に資するガイドライン作成を目的とした研究調査を実施する予定です。具体的には、欧米における副作用バイオマーカーの承認要件等について公表資料を調査し、さらに規制当局の担当者への質問・確認を行い、規制の仕組みや承認事例のエビデンスレベルをまとめます。これに加え、既報のRNAバイオマーカー分子をモデルとして、その定量法を開発し、その再現性や頑健性に関する一連の評価試験を実施します。これらの成果をもとに、本邦におけるRNAバイオマーカーの分析法バリデーションに関する留意点文書を作成する予定です。
- 「マイクロサンプリングに関する生体試料中薬物濃度分析(バイオアナリシス)手法の標準化」(齊藤・孫)
研究課題(革新的医薬品等開発のための次世代安全性評価法の開発・標準化と基盤データ取得)の一環として、マイクロサンプリング手法の適用に関する標準的方法及び、マイクロサンプリングを適用するためのバイオアナリシス手法に関して標準的な方法を確立することを目的としています。当室では下記の3分担課題を担当しています。
- マイクロサンプリング技術の標準化(齊藤)
- バイオマーカーに関するバイオアナリシス手法の標準化(齊藤)
- 生体試料中の核酸医薬品定量法の開発と評価への応用(孫)
非臨床トキシコキネティクス試験へのマイクロサンプリング適用に関するICHガイドラインのQ&Aが最終化され、国内でも平成31年3月15日に事務連絡として発出されたが、実際の適用に関する標準的方法は確立されていません。そこで本研究は、マイクロサンプリング技術を実際のトキシコキネティクス試験に適用するための標準的方法やスキームを確立し、その方法を用いた実データを基に関係者間で合意を形成し、技術指針をまとめることを目的としています。当室は低分子医薬品の分析担当として参加しています。
バイオマーカーのバイオアナリシス手法については、現行のガイドラインで対象とされておらず、バリデーション項目や許容限度基準にコンセンサスが存在していません。また、バイオマーカーがヒト血漿等のマトリックス中に内在的に含まれていることから、低分子・高分子医薬品のバイオアナリシスの基準をそのまま当てはめることは難しく、実際に実験データに基づいて検討を行い、標準化法・スキームを確立すること、留意点に関する関係者の合意を形成することが必要です。そこで本研究では、低分子バイオマーカー(脂質分子)と高分子バイオマーカー(ペプチド)を対象に、マイクロサンプリング手法の適用及びLC/MSを用いた試料測定について、特に検討を要する項目を主とする研究を行い、標準法の確立を目標としています。
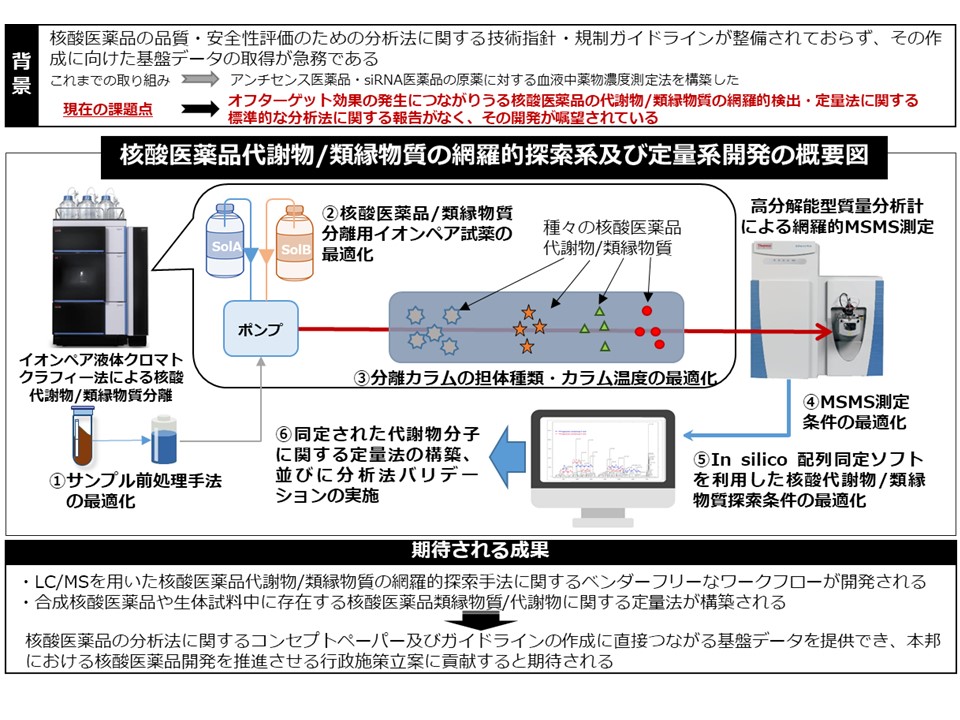
核酸医薬品とは主として修飾核酸が連結したオリゴ核酸であり、難治性遺伝疾患等の治療における新規モダリティーとして注目されています。核酸医薬品の臨床開発研究は近年益々活発化している一方で、現状核酸医薬品の非臨床・臨床開発におけるその原薬、代謝物、類縁物質等に関する分析法の規制ガイドラインは未だ整備されておらず、新規開発参入の足かせの一つとなっています。当室では、その品質・有効性・安全性の確保に資するレギュラトリーサイエンス研究を行っている遺伝子医薬部と連携し、生体試料中の核酸医薬品(アンチセンス医薬品及びsiRNA医薬品)の濃度測定に利用可能な高感度高速液体クロマトグラフ質量分析計測定系の構築に取り組んでいます。これまでに、アンチセンス医薬品について、既存の分析法と比べ2-10倍高感度な血中濃度測定系を構築し、多施設共同分析法バリデーションにてその再現性を確認しています。今後は、上述の核酸医薬品代謝物の網羅的測定法や定量法の開発に取り組む予定です。本研究は、核酸医薬品の分析法に関するコンセプトペーパー及びガイドラインの作成に直接つながる成果を提供でき、日本における核酸医薬品開発を推進させる行政施策立案に貢献すると期待されます。
- 作成中(荒川)
- バイオマーカー分析法バリデーションの検討・留意点文書作成(齊藤)
研究課題(医薬品の安全性および品質確保のための医薬品規制に係る国際調和の推進に関する研究“バイオマーカー分析法バリデーション検討グループ”)の一環として実施しており、当室は事務局及び専門員として参加しています。バイオマーカー分析法のバリデーションについてはガイドラインが存在しないため、海外における留意点文書や白書、特性が異なるものの参考となりうる医薬品分析法バリデーションを参照し、本邦における、業界団体代表者との合意形成、ガイドラインの礎となる留意点文書の作成を目的としています。
- GRIFIN(齊藤)
理化学研究所を代表とした共同研究(精神・神経疾患治療薬及びがん治療薬におけるファーマコゲノミクス研究)の一環として実施しており、当室ではメタボローム解析を担当しています。医薬品を投薬する前の患者血漿を解析し、投薬後の副作用の発症や有効性を追跡調査することで、副作用の発症や有効性指標と連動する代謝物を探索し、投薬前において副作用や薬効の予測しうるバイオマーカーの探索を目的としています。
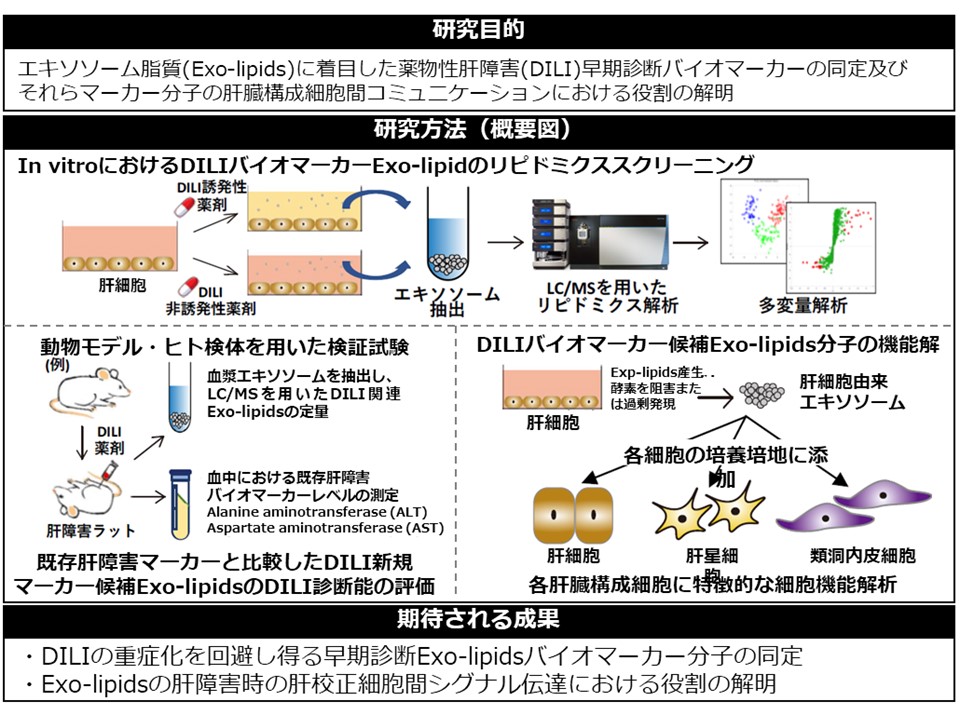
- 薬物性肝障害に対する新規細胞外膜小胞脂質バイオマーカーの探索(孫)
本研究は、医薬品の重篤な副作用の一つである薬物性肝障害を予測し、その発生を未然に防ぐことを目標とし、本副作用の早期検出を可能とする新規バイオマーカー分子の同定・検証を目的としています。探索ソースとしては、近年低侵襲的な診断法開発で注目されている細胞外膜小胞である「エキソソーム」に含有される脂質に着目し、最先端の脂質分析技術を用い、肝障害動物・培養細胞モデル・並びにヒト検体を利用した多角的な探索研究を行う予定です。また、本研究では同定されたエキソソーム脂質バイオマーカー分子の産生機序並びに肝臓構成細胞間のコミュニケーションにおけるその重要性の解明に関する基盤研究も実施する予定です。本件研究により、薬物性肝障害が重症化する前に早期検出し、本副作用による死亡数を減少させることが可能な新規バイオマーカー分子が開発されることが期待され、医薬品のより安全な使用・開発の実現に貢献できると期待されます。
- GAPFREE(齊藤)
昨年度までに実施していた研究課題(多層的オミックス解析による、がん、精神疾患、腎疾患を対象とした医療技術開発)の一環として、主に、国立国際医療研究センターとの共同研究により、腎疾患のバイオマーカーを、国立精神神経医療研究センターとの共同研究により、精神疾患のバイオマーカーを探索しました。それぞれの疾患について特徴的に変動する代謝物を同定し、今後は共同研究先と連携して、創薬や診断への応用を検討しています。
- ヒト脳由来エクソソームを用いた疎水性メタボローム解析(齊藤)
国立精神神経医療研究センターとの共同研究(ヒト脳由来のエクソソームを利用した認知症の病態解析又は創薬ターゲットの開発)の一環として実施しており、当室ではエクソソームの疎水性メタボローム解析を担当しています。SOPを構築し、研究班全体で統一した手法によって精製したエクソソームの解析を行った結果、疎水性分子の存在量の少ないことが明らかになり、微量試料の解析法として分析機器の構成及び分析条件の改良を実施しています。
研究業績
- 2022年
-
- Ohtsuka H, Takahashi K, Kitaura H, Kandori H, Danbayashi K, Higuchi T, Jinno F, Nitta S, Mori K, Iwai A, Nakai K, Saito K, Saito Y.: No obvious toxicological influences of 50 μL microsampling from rats administered phenacetin as a drug with hematological toxicity. J Toxicol. Sci., 2022; 47:193-199. (May)
- Muta K, Saito K, Kemmochi Y, Masuyama T, Kobayashi A, Saito Y, Sugai S. Phosphatidylcholine (18:0/20:4), a potential biomarker to predict ethionamide-induced hepatic steatosis in rats. J Appl Toxicol. 2022; 42: 1533-1547. (Sep)
- Arakawa N, Matsuyama S, Matsuoka M, Kitamura I, Miyashita K, Kitagawa Y, Imai K, Ogawa K, Maeda T, Saito Y, Hasegawa C. Serum stratifin and presepsin as candidate biomarkers for early detection of COVID-19 disease progression. J Pharmacol Sci., 2022; 150: 21-30.(Sep)
- Saito K, Ishikawa R, Kitamura I, Ogawa K, Arakawa N, Sun Y, Imai K, Maeda T, Saito Y, Hasegawa C. Characterization of serotonin as a candidate biomarker of severity and prognosis of COVID-19 using LC/MS analysis. J Pharmacol Sci, in press.
- Maeda K, Takikawa H, Aiso M, Kagawa T, Watanabe M, Sato K, Sakisaka S, Hiasa Y, Takei Y, Ohira H, Hashimoto E, Ayada M, Ikegami T, Arakawa N, Kusuhara H, Saito Y, Sugiyama Y: Frequency of null genotypes of glutathione S-transferase M1 and T1 in Japanese patients with drug-induced liver injury. Hepatol Res. in press.
- Arakawa N, Ushiki A, Abe M, Matsuyama S, Saito Y, Kashiwada T, Horimasu Y, Gemma G, Tatsumi K, Hattori N, Tsushima K, Miyashita K, Saito K, Nakamura R, Toyoda T, Ogawa K, Sato M, Takamatsu K, Mori K, Nishiya T, Izumi T, Ohno Y, Saito Y and Hanaoka M: Stratifin as a novel diagnostic biomarker in serum for diffuse alveolar damage. Nat Commun. 2022, 13: 5854. (Oct)
- 2021年
-
- Saito K. Application of comprehensive lipidomics to biomarker research on adverse drug reactions. Drug Metab. Pharmacokinet. 2021; 37: 100377. doi: 10.1016/j.dmpk.2020.100377. (Apr)
- Saito K, Hattori K, Hidese S, Sasayama D, Miyakawa T, Matsumura R, Tatsumi M, Yokota Y, Ota M, Hori H, Kunugi H. Profiling of Cerebrospinal Fluid Lipids and Their Relationship with Plasma Lipids in Healthy Humans. Metabolites. 2021 Apr 24;11(5):268. doi: 10.3390/metabo11050268. (Apr)
- Sanoh S, Saito K. Omics analyses and their application for the discovery of biomarkers reflecting drug efficacy and adverse reaction. Drug Metab Pharmacokinet. 2021; 39: 100405. doi: 10.1016/j.dmpk.2021.100405. (Aug)
- Kimura A, Arakawa N, Kagawa H, Kimura Y, Hirano H. Phosphorylation of Ser1452 on BRG1 inhibits the function of the SWI/SNF complex in chromatin activation. J Proteomics. 2021 ; 247: 104319. doi: 10.1016/j.jprot.2021.104319. (Jul)
- Miyagi E, Arakawa N, Sakamaki K, Yokota NR, Yamanaka T, Yamada Y, Yamaguchi S, Nagao S, Hirashima Y, Kasamatsu Y, Kato H, Mogami T, Miyagi Y, Kobayashi H. Validation of tissue factor pathway inhibitor 2 as a specific biomarker for preoperative prediction of clear cell carcinoma of the ovary. Int J Clin Oncol. 2021; 26: 1336-1344. doi: 10.1007/s10147-021-01914-y. (Jul)
- Ohtsu Y, Tanaka S, Igarashi H, Kakehi M, Mori T, Nakamura T, Ohashi R, Shimizu H, Yasuda Y, Okayama T, Kakuo H, Yokoi H, Horiuchi M, Katashima M, Nakamura R, Saito K, Saito Y: Analytical Method Validation for Biomarkers as a Drug Development Tool: Points to Consider Bioanalysis, 2021; 13:1379-1389. doi: 10.4155/bio-2021-0173. (Sep)
- Ishikawa R, Saito K, Matsumura T, Arai K, Yamauchi S, Goda R, Tachiki H, Kawabata M, Nitta SI, Nagao A, Suga T, Uchiyama H, Nakai K, Asahina K, Yamaoka M, Saito Y., A multi-laboratory validation study of LC/MS biomarker assays for three lysophosphatidylcholines. Bioanalysis. 2021;13:1533-1546. doi: 10.4155/bio-2021-0150. (Oct)
- Solon E, Groseclose MR, Ho S, Tanaka K, Nakada N, Linehan S, Nishidate M, Yokoi H, Kaji H, Urasaki Y, Watanabe K, Ishida T, Komatsu R, Yoshida K, Yamazaki H, Saito K, Saito Y, Tanaka Y. Imaging Mass Spectrometry (IMS) for Drug Discovery and Development Survey: Results on Methods, Applications and Regulatory Compliance. Drug Metab. Pharmacokinet. 2021; 43:100438 (Dec)
- 2020年
-
- Saito K, Hattori K, Andou T, Satomi Y, Gotou M, Kobayashi H, Hidese S, Kunugi H.: Characterization of Postprandial Effects on CSF Metabolomics: A Pilot Study with Parallel Comparison to Plasma. Metabolites. 2020; 10: 185 (May).
- Imatoh T, Sai K, Saito Y.: The association between concurrence of infection and the onset of severe eruption or liver injury in patients using antipyretic analgesics: a matched-nested case-control study. J. Clin. Pharmacol. 2020; 60: 1177-1184. (Sep)
- Yokoyama H, Hattori N, Ohtsuka H, Murata E, Kobayashi A, Muta K, Takumi A, Kitaura H, Jinno F, Iwai A, Nakai K, Mori K, Saito K, Saito Y.: Lack of toxicological influences by microsampling (50 µl) from jugular vein of rats in a collaborative 28-day study. J Toxicol. Sci., 2020; 45, 319-325 (June).
- Hattori N, Takumi A, Saito K, Saito Y. Effects of serial cervical or tail blood sampling on toxicity and toxicokinetic evaluation in rats. J Toxicol. Sci., 2020; 45, 599-609 (Oct).
- Saito K, Kagawa T, Tsuji K, Kumagai Y, Sato K, Sakisaka S, Sakamoto N, Aiso M, Hirose S, Mori N, Tanaka R, Uraoka T, Takata K, Ogawa K, Mori K, Sato M, Nishiya T, Takamatsu K, Arakawa N, Izumi T, Ohno Y, Saito Y, Takikawa H. Plasma lipid profiling of three types of drug-induced liver injury in Japanese patients: A preliminary study. Metabolites, 2020; 10: 355. (Aug).
- Sun Y, Nitta SI, Saito K, Hosogai R, Nakai K, Goda R, Kakehi M, Murata K, Yamaguchi T, Okuzono T, Yamane S, Enoki Y, Kawabata M, Takahara K, Sato S, Yoshida T, Inoue T, Saito Y.: Development of a bioanalytical method for an antisense therapeutic using high-resolution mass spectrometry. Bioanalysis, 2020; 12: 1739-1756.(Dec)
- 2019年
-
- Saito K, Tanaka N, Ikari J, Suzuki M, Anazawa R, Abe M, Saito Y, Tatsumi K. Comprehensive lipid profiling of bleomycin-induced lung injury. J Appl Toxicol. 2019 Apr;39(4):658-671.
- Sun Y, Saito K, Iiji R, Saito Y. Application of Ion Chromatography Coupled with Mass Spectrometry for Human Serum and Urine Metabolomics. SLAS Discov. 2019 Aug;24(7):778-786.
- Sun Y, Saito K, Saito Y. Lipid Profile Characterization and Lipoprotein Comparison of Extracellular Vesicles From Human Plasma and Serum. Metabolites. 2019 Nov 1;9(11):259.
- Saito K, Yagi H, Maekawa K, Nishigori M, Ishikawa M, Muto S, Osaki T, Iba Y, Minatoya K, Ikeda Y, Ishibashi-Ueda H, Ogino H, Sasaki H, Matsuda H, Saito Y, Minamino N. Lipidomic Signatures of Aortic Media From Patients With Atherosclerotic and Nonatherosclerotic Aneurysms. Sci Rep. 2019 Oct 29;9(1):15472.
- Saito K, Ueno S, Nakayama A, Nitta SI, Arai K, Hasunuma T, Saito Y. Overall Similarities and a Possible Factor Affecting Plasma Metabolome Profiles Between Venous and Capillary Blood Samples From 20 Healthy Human Males. J Pharm Sci. 2019 Nov;108(11):3737-3744.
- Izumi Y, Matsuda F, Hirayama A, Ikeda K, Kita Y, Horie K, Saigusa D, Saito K, Sawada Y, Nakanishi H, Okahashi N, Takahashi M, Nakao M, Hata K, Hoshi Y, Morihara M, Tanabe K, Bamba T, Oda Y. Inter-Laboratory Comparison of Metabolite Measurements for Metabolomics Data Integration. Metabolites. 2019 Oct 31;9(11):257.
- 2018年
-
- Kitamura K, Ito R, Umehara K, Morio H, Saito K, Suzuki S, Hashimoto M, Saito Y, Anzai N, Akita H, Chiba K, Furihata T. Differentiated HASTR/ci35 cells: A promising in vitro human astrocyte model for facilitating CNS drug development studies. J Pharmacol Sci. 2018 Aug;137(4):350-358.
- Saito K, Ikeda M, Kojima Y, Hosoi H, Saito Y, Kondo S. Lipid profiling of pre-treatment plasma reveals biomarker candidates associated with response rates and hand-foot skin reactions in sorafenib-treated patients. Cancer Chemother Pharmacol. 2018 Oct;82(4):677-684.
- Goda K, Saito K, Muta K, Kobayashi A, Saito Y, Sugai S. Ether-phosphatidylcholine characterized by consolidated plasma and liver lipidomics is a predictive biomarker for valproic acid-induced hepatic steatosis. J Toxicol Sci. 2018;43(6):395-405.
- Sun Y, Woess K, Kienzl M, Leb-Reichl VM, Feinle A, Wimmer M, Zauner R, Wally V, Luetz-Meindl U, Mellerio JE, Fuentes I, South AP, Bauer JW, Reichelt J, Furihata T, Guttmann-Gruber C, Piñón Hofbauer J. Extracellular Vesicles as Biomarkers for the Detection of a Tumor Marker Gene in Epidermolysis Bullosa-Associated Squamous Cell Carcinoma. J Invest Dermatol. 2018 May;138(5):1197-1200.
- Sun Y, Piñón Hofbauer J, Harada M, Wöss K, Koller U, Morio H, Stierschneider A, Kitamura K, Hashimoto M, Chiba K, Akita H, Anzai N, Reichelt J, Bauer JW, Guttmann-Gruber C, Furihata T. Cancer-type organic anion transporting polypeptide 1B3 is a target for cancer suicide gene therapy using RNA trans-splicing technology. Cancer Lett. 2018 Oct 1;433:107-116.
- Morio H, Sun Y, Harada M, Ide H, Shimozato O, Zhou X, Higashi K, Yuki R, Yamaguchi N, Hofbauer JP, Guttmann-Gruber C, Anzai N, Akita H, Chiba K, Furihata T. Cancer-Type OATP1B3 mRNA in Extracellular Vesicles as a Promising Candidate for a Serum-Based Colorectal Cancer Biomarker. Biol Pharm Bull. 2018;41(3):445-449.
- Umehara K, Sun Y, Hiura S, et al. A New Conditionally Immortalized Human Fetal Brain Pericyte Cell Line: Establishment and Functional Characterization as a Promising Tool for Human Brain Pericyte Studies. Mol Neurobiol. 2018;55(7):5993-6006.
- 2017年
-
- Saito K, Ohno Y, Saito Y. Enrichment of resolving power improves ion-peak quantification on a lipidomics platform. J Chromatogr B Analyt Technol Biomed Life Sci. 2017 Jun 15;1055-1056:20-28.
- Goda K, Kobayashi A, Takahashi A, Takahashi T, Saito K, Maekawa K, Saito Y, Sugai S. Evaluation of the Potential Risk of Drugs to Induce Hepatotoxicity in Human-Relationships between Hepatic Steatosis Observed in Non-Clinical Toxicity Study and Hepatotoxicity in Humans. Int J Mol Sci. 2017 Apr 12;18(4).
- Saito K, Goda K, Kobayashi A, Yamada N, Maekawa K, Saito Y, Sugai S. Arachidonic acid-containing phosphatidylcholine characterized by consolidated plasma and liver lipidomics as an early onset marker for tamoxifen-induced hepatic phospholipidosis. J Appl Toxicol. 2017 Aug;37(8):943-953.
- Sun Y, Harada M, Shimozato O, Souda H, Takiguchi N, Nabeya Y, Kamijo T, Akita H, Anzai N, Chiba K, Furihata T. Cancer-type OATP1B3 mRNA has the potential to become a detection and prognostic biomarker for human colorectal cancer. Biomark Med. 2017 Aug;11(8):629-639.

