抗体医薬品・Fc融合タンパク質
抗体医薬品とは
抗体は、本来、生体防御に寄与するタンパク質で、免疫グロブリン(immunoglobulin)とも呼ばれます。抗体医薬品は、疾患関連分子に特異的に結合する抗体を遺伝子組換え技術等を応用して作製し、医薬品としたものです。20世紀半ばから、ヒト血漿から精製された免疫グロブリン製剤が感染症治療等に用いられてきましたが、1975年に、ケラーとミルシュタインによりマウスモノクローナル抗体作製技術が確立され、疾患関連分子に対して特異的な結合能を持つ抗体を人工的に作製することが可能となりました。続いて、マウスモノクローナル抗体の臨床応用に際して問題となった免疫原性を低減し、血中濃度の維持をも可能にする技術(キメラ型抗体、ヒト化抗体、ヒト抗体の作製技術)が開発され、今日では、多くの抗体医薬品が臨床応用されています。ヒト血漿から精製された免疫グロブリン製剤も、広義には抗体医薬品に含まれますが、ここでは、遺伝子組換え技術等を応用して作製されるモノクローナル抗体医薬品について解説します。
日米欧で承認された抗体医薬品
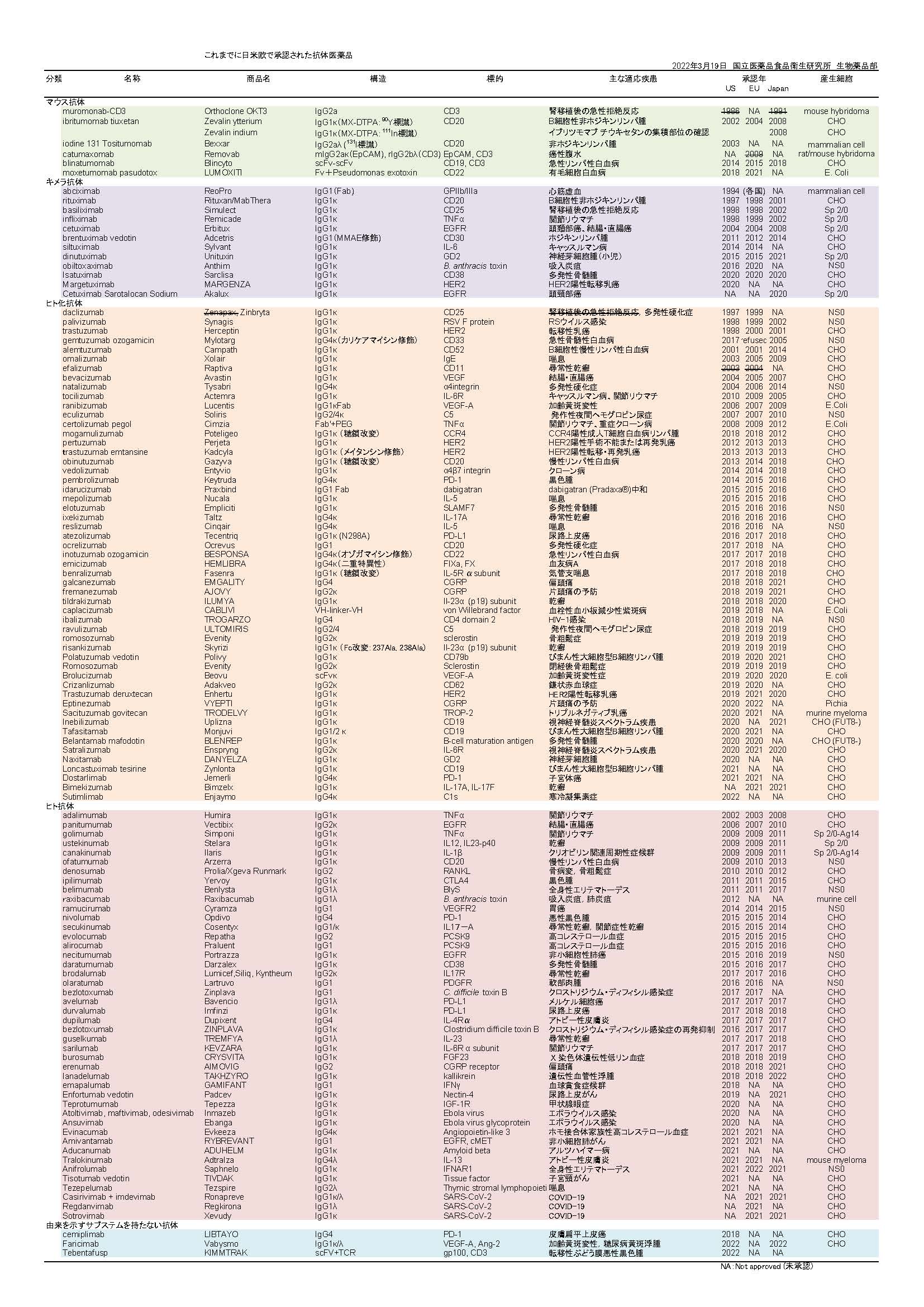
現在では、日米欧で100品目を越える抗体医薬品(表1,2022/3/19,PDF)が承認されています。その多くは、癌や自己免疫疾患を対象とするもので、治療に欠かせない存在となっている製品も少なくありません。また、最近では、有効性・安全性の向上を目指した各種の改変型抗体医薬品の開発も進んでいます。
各国で承認されている抗体医薬品に関する情報
- 日本:PMDA 医療用医薬品の添付文書情報
- 米国:FDA FDA Approved Drug Products
- 欧州:EMA European public assessment reports
抗体医薬品の構造
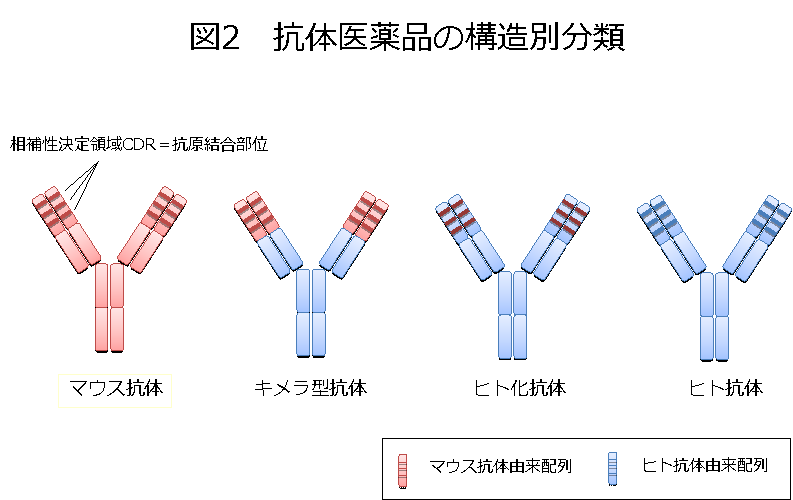
抗体は、抗原結合に関与する可変部、及び、定常部から構成されています(図1, PDF)。ヒトの免疫グロブリンには、IgG、IgM、IgD、IgE、IgAという5つのクラスがありますが、これまでに承認されている抗体医薬品は、全てIgG由来の配列を持つものです。現在までに承認されている抗体医薬品は、遺伝子の由来から、主に4種類(マウス抗体、キメラ型抗体、ヒト化抗体、ヒト抗体)に分類されます(図2, PDF)。

抗体医薬品の名称
INN 新ルール
INNの抗体医薬品の名称ルールについて、2021年11月に大幅な改正が行われました(新ルール)。
これにより、旧ルールでは、抗体医薬品の一般名称に-mabというステムが付けられていましたが、
表2 (PDF) の定義に変更され、サブステムについても、表3 (PDF) の定義に変更されました。
- INN for biological and biotechnological substances
- New INN monoclonal antibody (mAb) nomenclature scheme (PDF)
- マウスモノクローナル抗体の作製法開発
Kohler, G. & Milstein, C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 256, 495–497 (1975) - キメラ型抗体の作製法開発
Morrison, S. et al. Chimeric human antibody molecules: mouse antigen-binding domains with human constant region domains. Proc. Natl. Acad. Sci. USA 81, 6851–6855 (1984) - ヒト化抗体の作製法開発
Jones, P.T. et al. Replacing the complementarity-determining regions in a human antibody with those from a mouse. Nature 321, 522–525 (1986) - ファージディスプレイ法による抗体作製法開発
McCafferty, J. et al. Phage antibodies: filamentous phage displaying antibody variable domains. Nature 348, 552–554 (1990) - ヒト抗体作製法開発
Lonberg, N. et al. Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature 368, 856–859 (1994)
Green, L.L. et al. Antigen-specific human monoclonal antibodies from mice engineered with human Ig heavy and light chain YACs. Nat. Genet. 7, 13–21 (1994) - TGN1412臨床試験
Suntharalingam G. et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 355, 1018-28 (2006)
表2 抗体医薬品の一般名称におけるステム
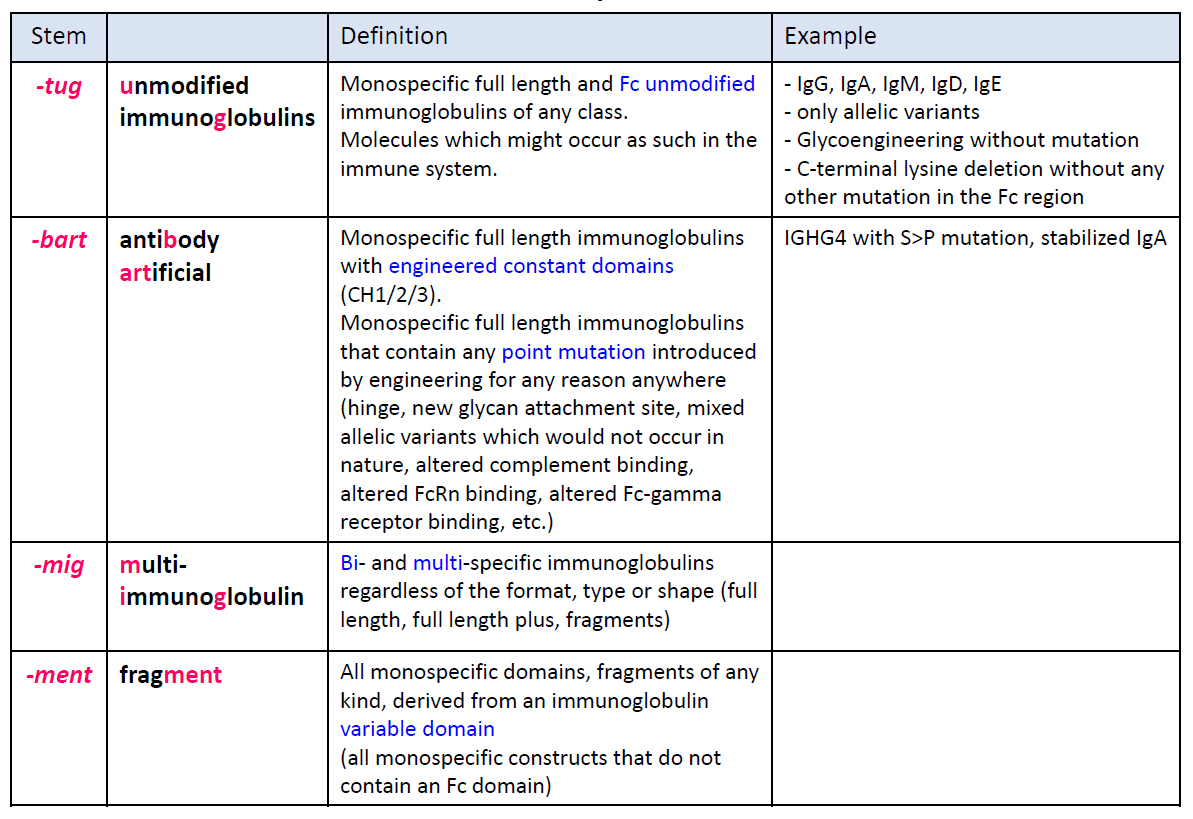
表3 抗体医薬品の一般名称におけるサブステム
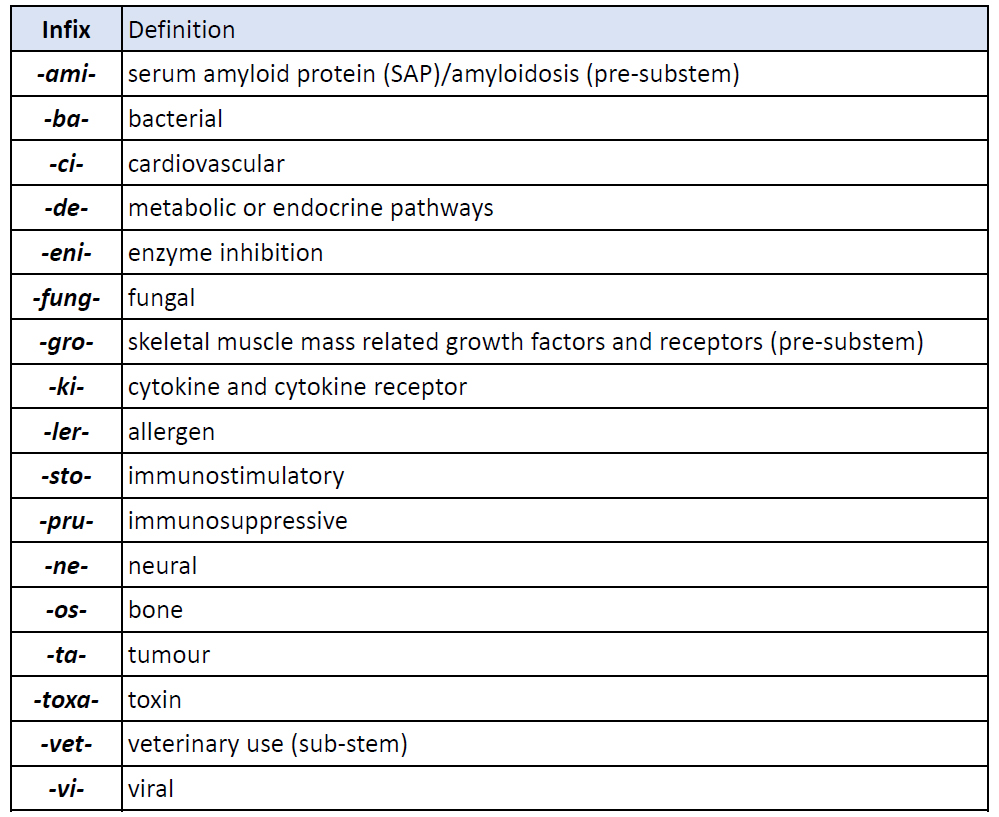
INN 旧ルール
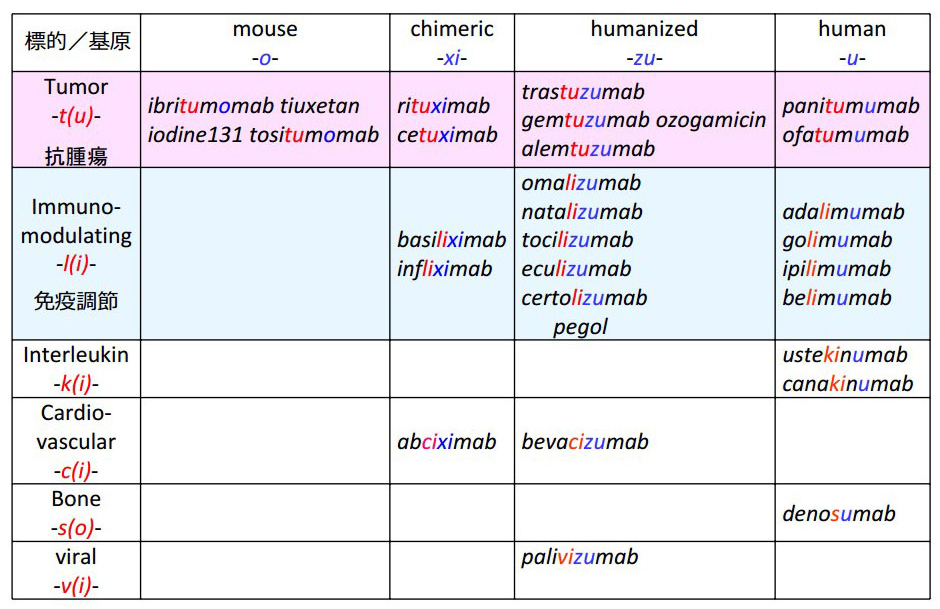
旧ルールにおいて、抗体医薬品の一般名称には、共通して、-mabというステムが付けられていました。また、表4のように、由来する種を表すサブステム、及び、標的のクラスに応じたサブステムが付けられていました。旧ルールの抗体医薬品の国際一般名称は、表5 (PDF) に示しました。
表4 抗体医薬品の一般名称におけるサブステム(旧ルール)
| tumor | -t(u)- |
| immunomodulating | -l(i)- |
| interleukin | -k(i)- |
| cardiovascular | -c(i)- |
| bone | -s(o)- |
| viral | -v(i)- |
| マウス抗体 | -o- |
| キメラ抗体 | -xi- |
| ヒト化抗体 | -zu- |
| ヒト抗体 | -u- |
| ラットマウスハイブリッド抗体 | -axo- |
表5 抗体医薬品の国際一般名称(旧ルール)
抗体医薬品の製造・品質管理
<製造>
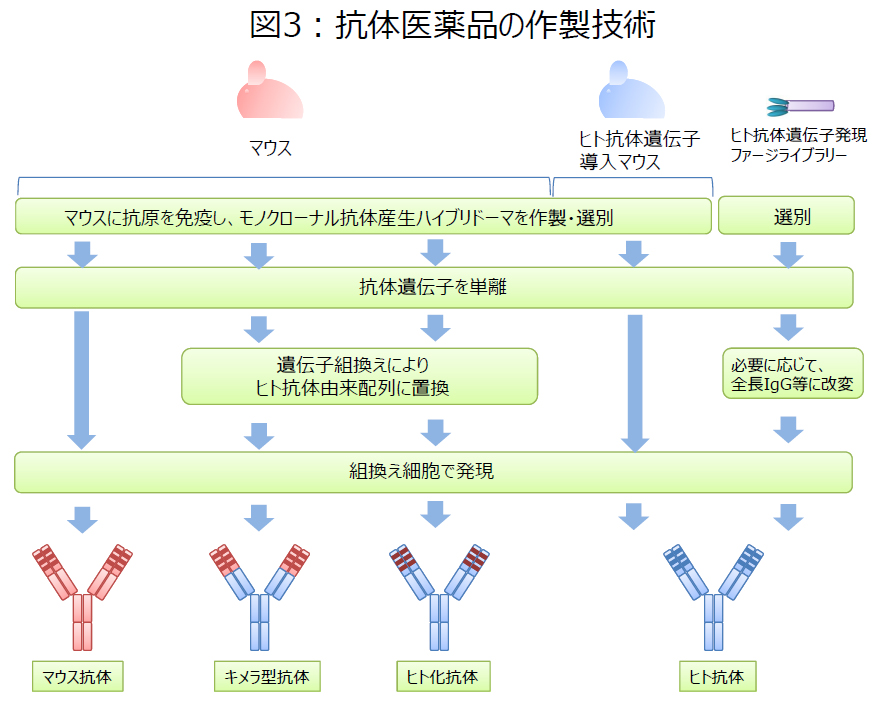
抗体医薬品は、標的分子との結合性等を指標に取得・選択された抗体の遺伝子を、組換えタンパク質発現用の細胞に導入して、医薬品生産用の細胞株を樹立することにより製造されます*(図3, PDF)。抗体は糖鎖を持つ高分子量タンパク質であるため、IgG全長の骨格を持つ抗体医薬品の製造には、動物細胞が用いられます。最もよく用いられているのはCHO(チャイニーズハムスター卵巣)細胞です。その他、Sp2/0細胞やNS0細胞といったマウス骨髄腫細胞が用いられる場合もあります(表1)。一方、Fc領域を持たない低分子抗体は、大腸菌で製造することが可能です。(*既承認抗体医薬品のうち、マウス抗体の中には、遺伝子組換えによらず、ハイブリドーマを用いて生産されているものもあります。)
動物細胞の培養上清中に分泌された抗体は、Fc領域に親和性を持つプロテインAをリガンドとするアフィニティークロマトグラフィーにより精製されることが一般的です。プロテインA溶出画分について、さらに別の分離様式を持つクロマトグラフィーを用いた精製を行うことにより、抗体医薬品原薬が得られます。
<品質管理>
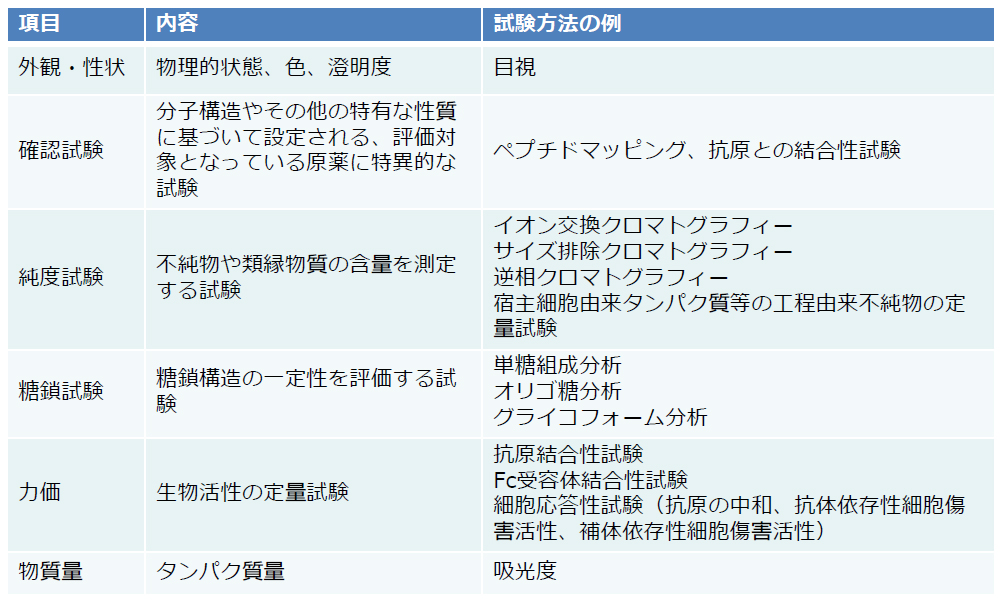
他のバイオ医薬品の場合と同様、抗体医薬品の品質管理では、表6(PDF)に示すような試験が行われています。これらは、抗体医薬品の開発過程で実施された品質特性解析、製造工程評価、安定性試験、非臨床・臨床試験等の結果をもとに設定されるものです。試験方法と、各試験に関する適否の判定基準(規格)のセットは、「規格及び試験方法」と呼ばれ、品質管理の要となるものです。製造ロットごとに、規格及び試験方法への適合性が試験され、出荷判定が行われています。
これまでに開発されている多くの抗体医薬品はIgG構造を持っており、製品が異なっていても、骨格構造は共通しています。そのため、培養や精製工程において、異なる製品についても共通した手法を用いることが可能です。このような技術は、プラットフォーム技術と呼ばれています。近年、バイオ医薬品についても、製造工程の合理的な設計と管理により品質管理を行うことが試みられつつあります。プラットフォーム技術が適用可能な抗体医薬品は、製造工程と品質に関する研究のモデルとして適していると考えられており、海外では、ケーススタディ(A-Mab:a Case study in Bioprocess Development ,CMC Biotech Working Group)が報告されています。
抗体医薬品の作用機構
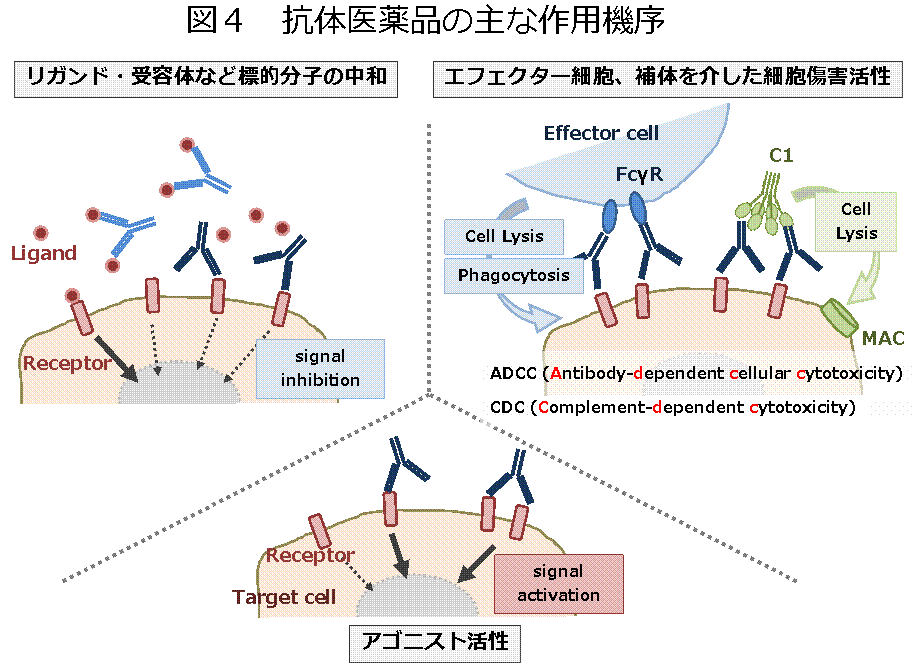
抗体医薬品の作用は、主として、標的分子(抗原)との結合により発揮されます(図4, PDF)。多くの抗体は、標的分子の作用を中和する活性を持っています。例えば、標的分子がサイトカイン等の可溶性分子の場合は、抗体により、標的分子の受容体への結合が阻害されます。標的分子が受容体の場合は、抗体との結合により、受容体へのリガンドの結合が阻害されます。
本来、生体防御を担う分子である抗体は、Fc領域を介して、細胞傷害活性を担うエフェクター分子(Fcg受容体や補体)とも結合します。細胞表面に存在する標的分子と結合した抗体がFcg受容体を活性化して標的細胞を傷害する活性は、抗体依存性細胞傷害(ADCC : antibody dependent cellular cytotoxicity)活性と呼ばれます。抗腫瘍効果を持つ抗体では、ADCC活性が薬効発現に関与している場合があります。また、抗体が補体と結合することにより標的細胞を傷害する活性は、補体依存性細胞傷害(CDC : complement dependent cytotoxicity)活性と呼ばれます。これらの他、標的分子を介したシグナル伝達を活性化するアゴニスト作用を示す抗体もあります。
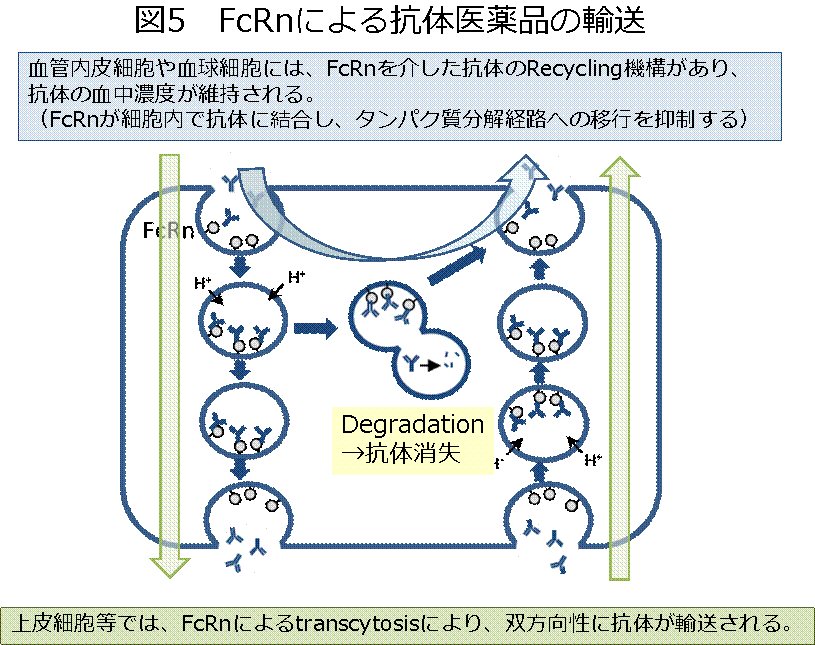
抗体はさらに、Fc領域を介して、体内動態を制御する分子FcRnとも結合します。FcRnは細胞に取り込まれた抗体を分解から保護して血中にリサイクルする作用や、トランスサイトーシスにより、抗体を輸送する作用を持っています(図5, PDF)。
抗体は、このように分子内に複数の機能を持つ多機能分子であると言えます。抗体医薬品の作用機構、ならびに、作用発現に関わるタンパク質としての機能、及び、その機能を生み出す構造・物理的化学的性質の評価は、抗体医薬品の有効性・安全性を確保するための重要な課題です。
抗体医薬品の安全性
抗体医薬品の副作用としては、標的分子との結合に起因すると考えられるもの、すなわち薬理作用の延長と考えられるものが少なくありません。標的分子が目的外の細胞・組織に発現している場合や、標的分子が複数の生理作用を持つ場合、抗体医薬品が標的分子に結合することにより、目的外の作用も生じることがあります。
例えば、関節リウマチの治療に用いられる抗TNFα抗体では、TNFαが関節リウマチの発症に関与している他、肺胞マクロファージの活性化や肉芽形成など、結核に対する生体防御も担っているため、TNFαの作用を阻害すると、副作用として結核の再燃がおこる場合があります。(結核再燃の予防のため、抗TNFα抗体では投与前に問診や検査を行うことが推奨されています。)
また、免疫抑制作用を持ついくつかの抗体医薬品では、免疫抑制の結果、潜伏感染しているJCウイルスの再活性化によるとされる進行性多巣性白質脳症(PML)が生じる例が知られています。PMLは致死的であるため、その発生リスクと治療によるベネフィットの関連は、製品の存在意義に関わるケースもあり、多発性硬化症に用いられる抗α4インテグリン抗体natalizumabは、販売が一時中止になっていた時期があります。また、乾癬治療に用いられていた抗CD11抗体efalizumab は、PML発症のリスクから、販売中止になっています(Efalizumabに関する情報:FDA、EMEA)。
抗体医薬品は標的分子に特異的に作用するため、開発段階では、非臨床試験結果からヒトでの作用・有害作用を予測することが難しいケースがあります。顕著な例が、TGN1412の例です。
2006年、英国で行われたヒト化抗CD28 アゴニスト抗体TGN1412の初回臨床投与試験では、実薬を投与された被験者6人が、サイトカイン放出症候群により、多臓器不全に陥る事故が起こりました。サルを含め、非臨床試験では検出されなかった作用がヒトで生じたとされ、アゴニスト抗体の非臨床評価の難しさを示す例として、よく知られています。この事故をきっかけに、ヒト初回投与量設定において、最少予測生物学的影響量(MABEL : Minimum Anticipated Biological Effect Level)を考慮することが提唱されました(EMEA: GUIDELINE ON STRATEGIES TO IDENTIFY AND MITIGATE RISKS FOR FIRST IN HUMAN CLINICAL TRIALS WITH INVESTIGATIONAL MEDICINAL PRODUCTS)。
抗体医薬品では、医薬品の投与時あるいは投与後24時間以内に、インフュージョン反応と呼ばれる副作用が起こることがあります。インフュージョン反応は、発熱、頭痛などを初期症状とし、通常は重篤ではないものの、死亡例も報告されています。TGN1412で生じたサイトカイン放出症候群もインフュージョン反応の一つと言えます。インフュージョン反応が生じる機構は複数あると考えられていますが、まだ十分には分かっていません。
抗体医薬品に関するガイドライン
表7 抗体医薬品を対象にしたガイドライン
Fc融合タンパク質
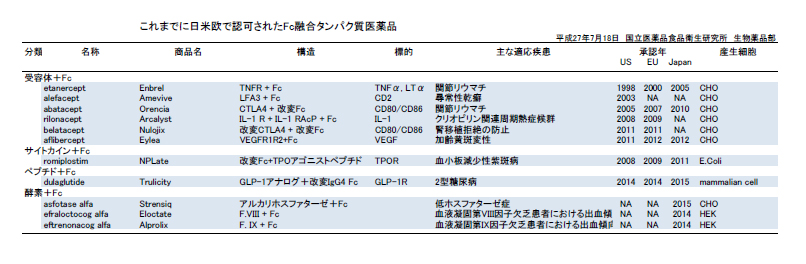
受容体細胞外ドメイン等の機能性タンパク質とIgGのFcドメインを融合させたタンパク質は、Fc融合タンパク質と呼ばれます(図6, PDF)。
Fc融合タンパク質は、IgGのFcドメインとの融合により血中半減期の延長を期待して人工的に設計されたものです。これまでに、日米欧で11品目のFc融合タンパク質医薬品が承認されています(表8, PDF)。

図6 Fc融合タンパク質
表8 既承認のFc融合タンパク質医薬品