バイオ医薬品と免疫原性
免疫原性とは?
一般的に、抗原が抗体の産生や細胞性免疫を誘導する性質を免疫原性と呼びます。バイオ医薬品は抗原として作用し、治療した患者さんで抗体の産生が誘導される場合があります。FDAの安全性情報に基づいたバイオ医薬品による抗体産生の誘導率に関する論文(1) では、誘導率は0%から約25%と製品により異なることが報告されています。このように抗体が誘導されることで場合によっては有効性・安全性に悪影響を及ぼす可能性があるため、バイオ医薬品の有効性・安全性を確保するためは、免疫原性について十分に理解し、評価することが重要です。
(1) Baker, M.P., Self Nonself, 1 (4), 314-322 (2010)
免疫原性がバイオ医薬品の有効性・安全性に及ぼす影響
バイオ医薬品に対する抗体が誘導されても、有効性や安全性において問題とならない場合がほとんどです。しかし、稀ではありますが、下記のような有効性が低下した事例や有害な反応を引き起こした事例が報告されています。
- 欧州において、インターフェロンベータの中和抗体(活性を打ち消すタイプの抗体)が誘導され、抗体価が高かった患者さんで治療効果が低下した (1, 2)。
- 1998年以降、欧州において、エポエチンアルファの中和抗体の誘導により、患者自身の内在性エリスロポエチンが作用しなくなり、赤芽球癆(赤血球の減少により起こる再生不良性貧血の1つ)が増加しました (3, 4)。添加剤のポリソルベート80によって製剤容器から溶け出した物質が、アジュバント(免疫原性を高める物質)として作用したことが発生原因の一つと考えられ、容器等の改善により、赤芽球癆は減少しました(5)。
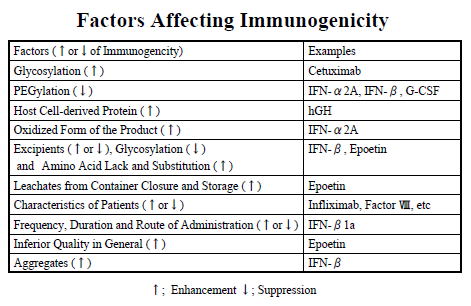
- Sorensen, P.S., et al., Neurology, 67 (9), 1681-3 (2006)
- Hesse, D., et al., Eur. J. Neurol., 14 (8), 850-9 (2007)
- Casadevall, N., et al., N. Engl. J. Med., 346 (7), 469-75 (2002)
- Gershon, S.K., et al., N. Eng. J. Med., 346 (20), 1584-6 (2002)
- Locatelli F., et al., Perit. Dial. Int., 27 (Suppl2), S303-7 (2006)
免疫原性に関するガイドライン
米国のガイドライン
- Guidance for Industry : Clinical Immunogenicity Considerations for Biosimilar and Interchangeable Insulin Products, Draft (2019) PDF
- Immunogenicity Testing of Therapeutic Protein Products-Developing and Validating Assays for Anti-Drug Antibody Detection (2019) PDF
- Guidance for Industry : Assay Development and Validation for Immunogenicity Testing of Therapeutic Protein Products, Draft (2016) PDF
- Guidance for Industry : Scientific Considerations in Demonstrating Biosimilarity to a Reference Product (2015) PDF
- Guidance for Industry : Immunogenicity Assessment for Therapeutic Protein Products (2014) PDF
- Guidance for Industry : Immunogenicity Assessment for Therapeutic Protein Products, Draft (2013) PDF
- Guidance for Industry : Assay Development for Immunogenicity Testing of Therapeutic Proteins, Draft (2009) PDF
欧州のガイドライン
- Guideline on Immunogenicity assessment of therapeutic proteins (2017) PDF
- Guideline on Immunogenicity assessment of biotechnology-derived therapeutic proteins , Draft (2015) PDF
- Concept paper on the revision of the guideline on assessment of biotechnology-derived therapeutic proteins, Draft (2014) PDF
- Guideline on immunogenicity assessment of monoclonal antibodies intended for in vivo clinical use (2012) PDF
- Guideline on immunogenicity assessment of monoclonal antibodies intended for in vivo clinical use, Draft (2010) PDF
- Concept paper on Immunogenicity assessment of monoclonal antibodies intended for in vivo clinical use, Draft (2009) PDF
- Guideline on Immunogenicity assessment of biotechnology-derived therapeutic proteins (2007) PDF
- Guideline on Immunogenicity assessment of biotechnology-derived therapeutic proteins, Draft (2007) PDF
- Concept paper on the revision of the guideline on Immunogenicity Assessment for Therapeutic Protein Products (2006) PDF
