Norwalk Virus Shedding after Experimental Human Infection
Emerging Infectious Diseases, Volume 14, Number 10-October 2008
http://wwwnc.cdc.gov/eid/article/14/10/pdfs/08-0117.pdf(PDF)
http://wwwnc.cdc.gov/eid/article/14/10/08-0117_article.htm
(食品安全情報2008年22号(2008/10/22)収載)
ノロウイルスは米国のウイルス性胃腸疾患の原因として最も頻度が高い。便中に排泄されるウイルスの量および期間を把握するため、ヒトへの実験感染を行った。
接種ウイルスの調製
過去のノロウイルス実験感染の参加者の水様性便をスクリーニングし、高濃度のノロウイルスRNA(逆転写PCR[RT-PCR]法により>107 U/mL)を含む投与に使用する株を選択した。また、現在の健康状態について当時の参加者のスクリーニングを行った(肝機能が正常範囲内、結核の皮膚反応[陰性]、胸部X線写真が正常、血清検査によりA、BおよびC型肝炎ウイルス、レトロウイルス[HIV-1, HIV-2およびヒトTリンパ球親和性ウイルス1、2]陰性、梅毒[迅速血漿レアギン検査で無反応])。接種用ウイルス(ロット42399)は、該当参加者1人からの水様性便を浄化、遠心分離、複数回のろ過(ろ過孔を段階的に小さくし、最終的に0.45μm)を行うことによって調製し、容器封入後 -80℃で保管した。
実験感染プロトコル
感染実験は、インフォームドコンセントが得られ、理解度テスト(test of understanding)に合格した健康な成人(18〜50歳)の参加者に対して、2004年9月から2006年10月にかけて行った。参加適格者はさらに以下の条件を満たしていた。分泌型が陽性(陰性の場合はノロウイルス感染に抵抗性であるため)、検査機関でのスクリーニング結果が正常範囲内(肝機能、腎機能、血球数)、血清検査により肝炎ウイルスおよびHIVに陰性、重篤な慢性疾患なし、接種前3カ月間に非細菌性胃腸疾患の病歴なし、接種前1カ月間に細菌もしくは原虫の腸内感染なし(接種前4週間のスクリーニング期間に腸内細菌培養3回、便中の虫卵、および寄生虫検査の検査結果が陰性)、より重篤なノロウイルス感染のリスクがあると考えられる者(免疫機能低下者、高齢者、小児など)と接触していない、および、他者にウイルスを伝播するリスクが高い仕事(食品関係、医療関係、航空業界関係等)に従事していないという条件を満たしていた。
接種当日、参加者はBaylor College of Medicine General Clinical Research Centerに入院し、様々な用量のウイルス(10倍段階希釈で4.8〜4,800 RT-PCRユニット)またはプラセボを夜の早い時間帯に経口接種された。参加者は最低96時間入院し、水様性便または嘔吐が少なくとも連続して18時間みられなくなってから退院した。入院中は4時間毎に臨床徴候および症状を診断し、全ての便を採取した。検体を採取直後に冷蔵し、検査機関に24時間以内に送付され、適宜処理後、分析時まで−70℃で保管した。退院後、21日間は毎日便検体をすべて採集し、その後最長で5週間は1週間に1度採集した(最長観察期間は接種後8週間)。参加者は試験開始前に手洗いと手の衛生の重要性について指導を受け、これはその後の検査通院のたびに繰り返された。Baylor College of Medicineの機関内評価委員会(Institutional Review Board)が臨床プロトコルの検討と承認を行い、米国食品医薬品局(FDA)が臨床プロトコルと試験接種ウイルスを記載したINDA(Investigational New Drug application:新薬研究申請書)をレビューした。
結果
ノロウイルスの接種を受けた参加者のうち16人で感染が成立し、このうち11人(69%)がウイルス性胃腸疾患の定義を満たした。満たさなかった5人は嘔吐または200g以上の水様性下痢のどちらも示さなかった。ウイルス性胃腸疾患を発症した11人全員が腹痛、悪心および嘔吐を呈し、このうち5人は200g以上の水様性下痢があり、1人は200g未満の水様性便であった。11人のその他の徴候および症状は倦怠感(n=9)、食欲不振(n=8)、頭痛(n=7)、筋肉痛(n=4)、37.6℃以上の発熱(n=4)および悪寒(n=3)であった。胃腸疾患の定義を満たさなかった5人は、悪心(n=5)、食欲不振(n=5)、倦怠感(n=4)、腹痛部痙攣(n=3)、筋肉痛(n=3)、頭痛(n=3)、37.6℃以上の発熱(n=2)、悪寒(n=2)および200g未満の水溶性下痢(n=2)を示した。本研究では各接種量グループに毎の参加者数は少なかったが、接種量の違いによる徴候および症状の明確な差異は認められなかった。徴候および症状の持続時間の中央値は23時間(範囲:10〜61時間)で、ウイルス性胃腸疾患の定義を満たしたグループと満たさなかったグループでほぼ同じであった。
表:ノロウイルスを接種された16人の試験参加者による便中へのウイルス排菌
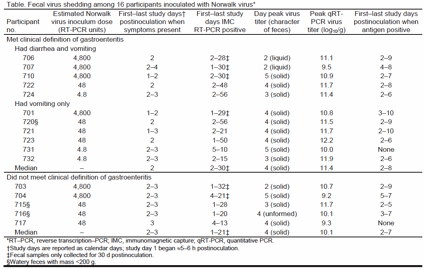
感染が成立した参加者全員にRT-PCR法によってウイルスの便中への排菌が認められ、血清抗体価は4倍以上上昇し、2人を除く全員で抗原ELISA法によってもウイルスの便中排菌が確認された(表)。IMC (immunomagnetic capture) RT-PCR法によって決められた、便中に初めてウイルスが検出された時期の中央値は、接種36時間後であり(範囲:18〜110時間後)、便中放出の持続期間の中央値は接種後28日間であった(範囲:13〜56日間)。7人では臨床徴候または症状が始まる3〜14時間前に便検体からノロウイルスが検出された。発症前の便中放出は、ウイルス性胃腸疾患の定義を満たす者より満たさない者に多かった(4/5対3/11、p=0.11,フィッシャーの両側正確検定)。抗原ELISA法の場合、これにより便中に初めてウイルスが検出されたのは、接種後約33時間(中央値は42時間後)であり、最後に検出されたのは接種10日後(中央値は7日後)であった。IMC RT-PCR法または抗原ELISA法によって決定されたウイルスの便中排菌の開始と終了の時期の中央値は、胃腸疾患の定義を満たさなかった者と満たした者でほぼ同じであった。
図1:便中へのノロウイルスの排出。便中のウイルスRNA量は定量的RT-PCR法(qRT-PCR;黒線)で、ウイルス抗原はELISA法で計測した(吸光度:青線)。参加者703番は胃腸疾患の臨床症状を呈さず(パネルA)、参加者721番は症状を呈した(パネルB)。図中の縦線は臨床症状の持続期間を示している;N:悪心、V:嘔吐。パネルC、D、Eはそれぞれ、C:胃腸疾患の臨床症状を呈さない、D:嘔吐のみの胃腸疾患症状を呈した、E:嘔吐および下痢症の胃腸疾患症状を呈した参加者の便検体のウイルスRNA量をqRT-PCRにより測定した。
(編者注:説明文中で吸光度を青線と記述しているが赤線の間違いであると思われる。)
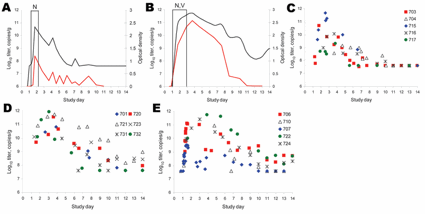
便中のノロウイルス濃度をqRT-PCR法で計測したところ、最高濃度となった日の中央値は接種4日後であり、ウイルス性胃腸疾患の定義を満たした者と満たさなかった者でほぼ同じであった。臨床徴候が消失した後に最高濃度となった者が11人(69%)いた。ウイルスの便中最高濃度の中央値は、95 x 109(範囲:0.5 x 109〜1,640 x 109)コピー/g(便)で、5人が少なくとも14日目まで100 x 106 コピー/g以上を便中排菌した。胃腸疾患の定義を満たした者は、満たさなかった者より便中ウイルス最高濃度の中央値が大きく(250 x 109 コピー/g対12 x 109 コピー/g、p =0.08、ウィルコクソン順位和検定)、接種後最初の2週間に便中排菌された総ウイルス量の平均値も胃腸疾患患者グループの方が高かった(1013.3対1012.4、p =0.056、スチューデントt検定)。接種後かなりの時間が経過した時期に採集された便中のウイルスの濃度は低かった(範囲:225,000〜40 x 106 コピー/g(便))。qRT-PCR法により求めた便中のウイルスタイターと、抗原ELISA法の間に強い相関関係が認められた(r=0.823、ピアソン相関、p <0.001)。
国立医薬品食品衛生研究所安全情報部