1.要 約
1.1 物質の同定、物理的・化学的特性、分析方法
直鎖アルキルベンゼンスルホン酸塩(LAS)、アルファオレフィンスルホン酸塩(AOS)、アルキル硫酸塩(AS)は、疎水基および親水基(極性)により特徴づけられた分子を有する陰イオン系の界面活性剤である。市販の混合物は、物理化学的特性の異なる異性体と関連化合物の類似物質により構成され、種々に適用するために製剤化されている。
LAS、AOS、ASは、非特異的な方法により分析できる。通常用いられるのは、メチレンブルーに反応する物質に対する方法の一種で、陰イオンおよび疎水基を含むすべての化合物に反応する。そのため、これを環境試料のために用いた場合には、分析上の妨害があり、その上、本法の感度は約0.02mg/lである。これに対する非特異的な代替方法が開発されているが、それらは一般的には使用されていない。環境分析のための特異的方法はLASおよびASについてのみ使用できる。メチレンブルー反応性と高速液体クロマトグラフィー(HPLC)による改善された方法がAOSの分析に利用できる。
LASは直鎖アルキルベンゼンのスルホン化により製造される非揮発性の化合物である。市販製品は、常に、長さのちがうアルキル鎖(C10~C13あるいはC14)の同族体と、フェノール環の位置のちがう(2~5フェノール)異性体との混合物である。LASの同族体と異性体のすべては、環境試料およびその他の媒体中において、HPLC、ガスクロマトグラフィー、ガスクロマトグラフィー質量分析法のような特殊な分析方法により測定が可能である。
AOSはアルファ-オレフィンのスルホン化により製造される非揮発性の化合物である。それらは、C14~C18の長さをもつアルキル鎖アルカンスルホン酸ナトリウムとヒドロキシアルカンスルホン酸塩の2種の化合物の混合物である。 ASは非揮発性の化合物で、石油化学系アルコールのサルフェーションによって製造される。C10~C18のアルキル鎖をもつ同族類の混合物である。環境モニタリングのためには特殊な分析方法が開発されている。
Ⅰ 直鎖アルキルベンゼンスルホン酸ナトリウム塩(LAS)
a 物質の同定
| 化学式 | CnH2n-1O3SNa(n:16~20) |
| 化学構造 | 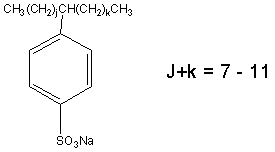
|
| 一般名 | sodium linear alkylbenzensulfonate |
| その他の名称 | LAS, LAS sodium salt, linear alkylbenzenesulfonic acid sodium salt, linear dodecylbenzenesulfonic acid sodium salt, sodium straight chain alkylbenzenesulfonate |
| 商品名 | Ablusol DBC, Agrilan WP, Alkasurf CA,
Arylan, Atlas G-3300B, Atlox, Biosoft, Berol,
Calsoft, Demelan CB-30, Elecut S-507,Elfan,
Emulphor ECB, Emulsogen Brands,
Gardilene, Hexaryl, Idet, Kllen, Lutopon SN,
Manro, Marlopon, Marlon A, Nacconol90F,
Nansa HS80, Nansa Lutersit, Neopelex,
Sandozin AM, Sipex, Sulfamin, Sulframin,
Surfax495,Teepol, Tersapol, Tersaryl, Ufaryl
DL80P, Witconate a |
| 略称 | LAS, LAS-Na |
| CAS登録番号 | 68411-30-3(LASナトリウム塩、C10~C13アルキル) |
LASは、高度に分岐しているアルキルベンゼンスルホン酸塩から生物学的により分解しやすい代替物質として、1960年代に導入された、陰イオン界面活性剤である。LASは、直鎖アルキルベンゼン(LAB)を三酸化硫黄(SO3)によりスルホン化し、通常流下膜式反応装置上、または回分反応装置内で発煙硫酸を用いて生成される。その後、カセイソーダなどのアルカリにより中和される。炭化水素中間体、LABは、一般に、主にフッ化水素(HF)または塩化アルミニウム(AlCl3)を触媒として使ったn-オレフィン、またはn-クロロパラフィンによるベンゼンのアルキル化により生成される。
LAS誘導体は、一般的にこのような方法が引用されている。b
LABの現在の全生産量(世界)のうち74%はフッ化水素触媒により、また26%は塩化アルミニウム触媒により生産されている。c
LASは、同族体およびフェニル基の位置の異なる異性体の混合物である。それぞれ、パラの位置でスルホン化した一つの芳香族環を含み、C10~C14(ヨーロッパではC10~C13が主流)のアルキル直鎖に一番端以外のいずれかの位置で結合している。洗剤には一般的にナトリウム塩の形で使用されている。
| a McCutcheon(1993) |
| b Cavalli et al.(1993) |
| c Berna et al.(1993) |
b 物理的・化学的特性
表 洗濯用洗剤に使用されている直鎖アルキルベンゼンの代表的な性質a
| 外観 | 白色ペースト(水を含む) |
| アルキル炭素鎖の長さ(平均) | 11.8 |
| 分子量(平均) | 342 |
| 非スルホン化物質 | 1~2% |
| アルキル鎖混合比 |
| C10 | 10~15% |
| C11 | 25~35% |
| C12 | 25~35% |
| C13 | 15~30% |
| C14 | 0~5% |
| フェニル環の位置 | LAS(LAB-HF b) | LAS(LAB-AlCl3c) |
| 2-フェニル | 18 | 28 |
| 3-フェニル | 16 | 19 |
| 4-フェニル | 17 | 17 |
| 5-フェニル | 24 | 18 |
| 6-フェニル | 25 | 18 |
| a Cavalli et al.(1993)より |
| b フッ化水素触媒プロセス |
| c 塩化アルミニウム触媒プロセス |
表 LASの化学的特性a
| アルキル炭素鎖 | 10 | 12 | 14 | 15 | 16 |
| クラフト点 | -1(℃) | 3(℃) | 8(℃) | - | 13(℃) |
臨界ミセル濃度
(CMC)(25℃) | 5.8×10-3 | 1.1×10-3 | 0.24×10-3 | 0.11×10-3 | - |
界面活性剤の水溶解性は、界面活性剤の結晶相と平衡状態にある溶解した分子濃度で定義され、温度の上昇につれて増加する。界面活性剤については、溶解度/温度曲線に特異な鋭い折れ(限界点)が観察される。限界点より上の急な上昇は、ミセル化により起こる。溶解度と温度の関数としてプロットした臨界ミセルカーブの交点はクラフト点と呼ばれ、界面活性剤の分子が単量体・ミセル・水和化合物固体として共存する点である。クラフト点に対応した温度は、クラフト温度と呼ばれる。クラフト温度および臨界ミセル濃度より上では、ミセル溶液を生成し、水溶解性は高くなる。
クラフト点は、100mlの水に1gのLASが溶解する温度で示す。
a Ohki & Tokiwa(1970)より
Ⅱ アルファオレフィンスルホン酸塩(AOS)
a 物質の同定
| 化学式 |
CnH2nO3SNa, CnH2n+1O4SNa(n:14~18) |
| 化学構造 |
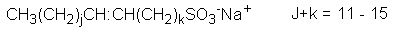
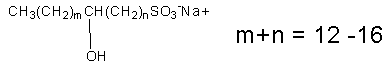
|
| 一般名 |
sodium alpha-olefinsulfonate, alpha-olefinsulfonic acid sodium
salt, AOS sodium salt |
| 商品名 |
Bioterge AS40F, Elfan OS46,Geropon MLS/A,
Hostapur OS Brands, Lipolan, Lipomix G, Lipon
PB-800,Lutensit A-PS, Nansa LSS38/AS,
Sawaclean, Sermul EA214,Sulframin AOS,
Witconate a |
| 略称 |
AOS, AOS-Na |
| CAS登録番号 |
29963-33-5 1-テトラデセンスルホン酸ナトリウム |
| 29734-60-9 ヘキサデセンスルホン酸ナトリウム |
| 13513-23-0 3-ヒドロキシヘキサデシル-1-スルホン酸ナトリウム |
| 26446-92-4 オクタデセン-1-スルホン酸ナトリウム塩 |
| 13513-42-3 3-ヒドロキシ-1-オクタデカンスルホン酸ナトリウム塩 |
AOSは、アルケンスルホン酸塩(60~65%)、ヒドロキシアルカンスルホン酸塩(30~35%)、ジスルホン酸塩(5~10%)の混合物である。アルケンスルホン酸塩とヒドロキシアルカンスルホン酸塩は、さまざまな位置の異性体が報告されている。b
C14~C16 AOSナトリウム塩は、通常、35~40%の活性物質を含む水溶液として出荷されている。C16~C18 AOSナトリウム塩は、通常、28~30%の活性物質を含むスラリーである。
| a McCutcheon(1989) |
| b Gentempo et al.(1985);Williamson(1993) |
b 物理的・化学的特性
表 アルファオレフィンの特性
| 外観 | 白色結晶性固体 |
AOSは、さまざまな性質をもつ種々の化合物とその異性体からなるC14~C16オレフィンとC16~C18オレフィンの2種に大別される。洗浄力は、C15~C18アルキル炭素鎖の時に最大になる。同様のアルキル炭素鎖の長さの範囲で、アルカリ洗浄助剤およびキレート剤を含む洗剤の配合においても最大の洗浄力が得られる。a
AOSは、熱い酸媒体においても安定している。 |
a Yamane et al.(1970)
表 AOSの化学的特性a
| アルキル炭素鎖 | 12 | 14 | 16 | 18 | 20 |
| クラフト点 | - | - | 10(℃) | 30(℃) | 40(℃) |
臨界ミセル濃度
(CMC)(25℃) | 4.0g/l | 1.0g/l | 0.3g/l | 0.1g/l | - |
| 表面張力(25℃) | - | 30dyne/cm | 33dyne/cm | 35dyne/cm | - |
界面活性剤の水溶解性は、界面活性剤の結晶相と平衡状態にある溶解した分子濃度で定義され、温度の上昇につれて増加する。界面活性剤では、溶解度/温度曲線に特異な鋭い折れ(限界点)が観察される。限界点より上の急な上昇は、ミセル化により起こる。溶解度と温度の関数としてプロットした臨界ミセルカーブの交点はクラフト点と呼ばれる。この点では、界面活性剤の分子が単量体・ミセル・水和固体として共存している。クラフト点に対応した温度は、クラフト温度と呼ばれる。クラフト温度および臨界ミセル濃度より上では、ミセル溶液を生成する。この状態では、溶解性は高くなる。
a Ohki & Tokiwa(1970)より
Ⅲ アルキル硫酸エステル(AS)
a 物質の同定
| 化学式 |
CnH2n+1O4SNa(n:10~18) |
| 化学構造 |
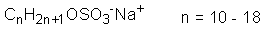
|
| 一般名 |
sodium alkylsulfate, sulfuric acid alkyl ester sodium salt,
alkylsulfate sodium salt, alcohol sulfuric ester sodium salt,
sodium dodecyl sulfate, sodium lauryl sulfate |
| 商品名 |
Akyporox SALSAS, Akyposal, Alphenate TFC76,
Alscoap LN, Aremsol, Berol, Cosmopon, Dehydag,
Elfan, Emal, Empicol, Gardinol, Genapol CRT40,
Manro, Marlinat KT50,Melanol LP1,Monogen,
Montopol CST, Montovol, Neopon LT, Nikkol,
Nissan Persoft SK, Perlankrol ATL-40,Perlankrol,
Polystep B, Rewopol, Sactipon, Sactol, Sandopan
KD, Sermul, Stepanol WA100,Sufatol, Sufetal,
Sulfopon, Sunnol, Surfax, Swascol, Teepol HB7,
Tensopol Tesapon, Texapon, Ufarol AM70,
Zoharpon, Zorapol LS-30 a |
| 略称 |
AS, AS-Na, SDS |
| CAS登録番号 |
151-21-3 (C12 AS) |
| 1120-04-3 (C18 AS) |
| 68130-43-8 (C8~C18 AS) |
ASは、高級アルコール硫酸エステル塩型の陰イオン界面活性剤である。原料アルコールの種類により、アルキル基は直鎖型または分岐鎖型となり、また単一鎖長型または混合鎖長型となる。通常アルキル基は一級である。
a McCutcheon(1993)
b 物理的・化学的特性
表 アルキル硫酸エステルの特性a
| 外観 | 白色結晶性粉末 |
物理的特性は、アルキル基により大きく異なる。通常は、混合物として生産され使用されている。
ASは、熱い酸媒体中ではすぐに加水分解される。
C10(27℃)、C12(25℃)、C14(40℃)、またはC16(40℃)のアルキル炭素鎖をもつ化合物は、臨界ミセル濃度より高い濃度で括弧内の温度の時40dyne/cmの表面張力を有し、表面張力を減少させる性質を呈している。a
25℃における洗浄能力は、アルキル炭素鎖C13までは増加し、C16まで一定となる。しかし、アルカリ洗浄助剤およびキレート剤を含む実際の洗剤の配合においては、C14化合物の時、最大の洗浄力が得られた。b |
| a | Dreger et al.(1944) |
| b | Yamane et al.(1970) |
表 ASの化学的特性a
| アルキル炭素鎖 | 8 | 12 | 14 | 16 | 18 |
| 臨界ミセル濃度b,c | 136 | 8.6 | 2.4 | 0.58 | 0.16 |
| (CMC)(mol/l)(25℃) | ×10-3 | ×10-3 | ×10-3 | ×10-3 | ×10-3 |
| 溶解性c,d | - | 15℃ | 28℃ | 42℃ | 55℃ |
| a | Ohki & Tokiwa(1970)より | b | Evans(1956)より |
| c | 界面活性剤の水溶解性は、界面活性剤の結晶相と平衡状態にある溶解した分子濃度で定義され、温度の上昇につれて増加する。界面活性剤では溶解度/温度曲線に特異な鋭い折れ(限界点)が観察される。限界点より上の急な上昇は、ミセル化により起こる。臨界ミセル濃度より上では、ミセル溶液を生成し、溶解性は高くなる。 |
| d | 10gのASが1lの水に溶解する温度(Gotte(1954)) |
1.2 ヒトおよび環境の暴露源
LAS、AOS、ASは、家庭用界面活性剤(合成洗剤)および個人用の衛生用品や特殊な用途に用いられる有効成分である。使用後は、そのような洗浄剤化合物は廃水中から環境中に排出される。
これらの化合物への職業暴露が存在する。ヒトの一般集団および環境中の生物の暴露は、LAS、AOS、AS(および他の界面活性剤)の用途、地域の汚泥処理の実施状況、受け入れる環境の特性などに依存する。
1990年における世界中での消費量は、LASで200万トン、AOSが8万6,000トン、ASが28万9,000トンであった。
1.3 環境中濃度
1.3.1 直鎖アルキルベンゼンスルホン酸塩(LAS)
LASの濃度は、その存在が予想されるほとんどすべての環境媒体中で、特殊で鋭敏な方法により分析されている。その濃度は、廃水>処理済み放出水>表層水>海水の順に漸減する。
LASが主な界面活性剤として用いられている地域の濃度は、廃水中では通常1~10mg/l、生物学的処理をされた放出水中では0.05~0.1mg/l、浸透濾過により処理された放出水中では0.05~0.6mg/l、汚泥排出口下流の表層水中で0.005~0.05mg/l(排出口の下流では急速に0.01mg/lに減少する)、河川の堆積物中では<1~10mg/kg(排出地区に近く高度に汚染された堆積物中では≦100mg/kg)、汚泥中では1~10g/kg、汚泥施用の土壌では<1~5mg/kg(当初は5~10mg/kg、異例に多量の汚泥の施用後には≦50mg/kgが報告されている)である。河口域の水中のLAS濃度は0.001~0.01mg/lであるが、廃水が直接放出された場合には高濃度を発生する。沖の海水中での濃度は<0.001~0.002mg/lである。
LASの環境中での濃度は、大幅に変化する点に留意すべきである。この変化は、分析方法の差、試料採取場所の特性(不適切な汚泥処理の高度汚染領域から、広範囲の汚泥処理を実施している領域までの範囲)、季節(2倍の差を示す)、LASの消費量に由来している。
環境モニタリングでは、環境媒体中では、時間の経過によるLASの蓄積は起こらないことを示している。土壌中の濃度は時間と共に増加せず、無機化(mineralization)により減少する。LASは厳密な嫌気性条件下(メタンを発生するような)では分解しないため、それらは嫌気性堆積物中で無機化する、との結論は下せないであろう。現在の使用量では、すべての受け入れ環境媒体でのLASの同化は流入量と等しく、これは定常状態を意味している。
1.3.2 アルファオレフィンスルホン酸塩およびアルキル硫酸塩(AOS & AS)
AOSの環境中濃度については、環境試料中のそれらの分析が困難のため、限られたデータしか入手できない。非特異的な比色定量分析法(メチレンブルーに基づく)は、一般的には陰イオン界面活性剤を検出できるが、それらは分析上の妨害のため、AOSの特定の濃度の測定には不適当である。環境試料中のAS測定には特殊な方法が開発されている。
実験室で実施された研究は、AOSおよびASはすべての環境媒体中で速やかに無機化され、実質的には処理中に汚泥から全部が除去される。表層水中、堆積物、土壌、河口域水、海洋環境における濃度はおそらく低いであろう。河川の水中のAOS濃度は低いことが見出されている。
1.4 環境中の移動、分布、変化
5~10℃以下の温度では、微生物活性の低下により、LAS、AOS、ASの生分解の速度は減少する。
1.4.1 直鎖アルキルベンゼンスルホン酸(LAS)
LASが環境内に入る経路は国により異なるが、主要な経路は下水処理施設からの放出を介してである。廃水処理施設がない、あるいは不十分な場合には、汚水は河川・湖沼・海洋に直接放流されるであろう。その他のLASの環境中への侵入経路は、農地への下水汚泥の散布である。
環境中への経路を通して、LASは吸着と、一次的な、または最終的な生分解との組み合わせにより除去される。LASは、媒体とその構造に依存して、40~5,200l/kgの吸着係数をもって、浮遊微粒子のコロイドの表面に吸着される。その生分解は、表層水中(半減期1~2日)、好気性堆積物(半減期1~3日)、海洋および河口域の生態系(半減期5~10日)において起こる。
下水の一次処理において、LASの約25%(10~40%の範囲)は汚泥に吸着され、廃棄汚泥と共に除去される。それらは嫌気性の汚泥の消化(digestion)によっては除去されないが、好気性の汚泥処理により取り除かれ、その半減期は約10日間である。土壌への汚泥の施用後には、一般的には、LASの90%は3カ月以内に分解され、その半減期は5~30日間である。
LASの魚体全体における濃縮係数は100~300の範囲内で、14C-LASと14C-代謝産物の合計である。魚類による取り込みは、主として鰓(えら)を通じて起こり、生体内変化の後に肝臓および胆嚢に分布される。LASは速やかに排泄されるため、生物濃縮されるという証拠はない。
1.4.2 アルファオレフィンスルホン酸塩(AOS)
AOSの環境内の移動、分布、変化に関して入手し得るデータは、LASのそれよりも少ない。AOSの環境内への移動は、LAS、AS、その他の界面活性剤で確立されている方法と類似しており、AOSの環境中の運命(fate)はLASおよびASに似ていると推定される。これは好気性条件下で容易に生分解し、その主要な生分解は温度に依存して2~10日間以内に完了する。AOSの生物濃縮については限られたデータの入手が可能であり、魚類においては生物濃縮は認められない。非生物的分解のデータは存在しない。
1.4.3 アルキル硫酸塩(AS)
環境中へのASの移動は、LASおよびAOSに働くメカニズムと同様である。それらは、実験室内および環境条件下における好気性および嫌気性条件下で容易に生分解し、主要な生分解は2~5日間以内に完了する。魚体中の生物濃縮係数は2~73の範囲内で、アルキル硫酸塩同族体の鎖長により変化する。ASは、魚類により、LASと同一の方法により、摂取・分布・生体内変化を受けて排泄され、水生生物中では生物濃縮されない。
1.5 体内動態
LAS、AOS、ASは消化管により容易に吸収され、生体内に広く分布し、広範に代謝される。LASは、ω-およびβ-酸化を受ける。吸収された量の一部は胆汁排出により糞中に代謝産物として排泄されるが、親化合物および代謝産物は主として腎臓より排泄される。
LAS、AOS、ASとの長時間の接触は表皮のバリア(dermal barrier)の正常な機能(integrity)を損なうが、ごく少量のみが無傷の(intact)(訳者注:自然のまま何らの損傷も加えられていない状態をいう)皮膚を通して吸収されるように見える。高濃度の場合には、より多くが吸収され、浸透に要する時間は短縮されるであろう。
1.6 実験動物およびin vitro(試験管内)試験系への影響
LASのナトリウム塩の経口LD50(50%致死量)値は、ラットにおいて404~1,470mg/kg体重、マウスでは1,259~2,300mg/kg体重であり、LASの毒性に対してラットはマウスよりも感受性が高いことを示唆している。マウスにおいては、AOSのナトリウム塩に対して3,000mg/kg体重の経口LD50値が測定されている。ラットにおけるASの経口LD50値は1,000~4,120mg/kg体重である。LAS、AOS、ASは皮膚および眼を刺激する。
食餌あるいは飲料水中に120mg/kg体重/日以上の用量と同等の濃度のLASを投与されたラットの亜慢性実験では、肝臓においてごく軽度の生化学的および組織病理学的変化が報告されている。1件の試験においては、低用量により肝細胞に超微構造上の(ultrastructural)変化が認められたが、この変化は可逆的のように見えた。同様の用量による他の試験では影響は見られなかったが、最初の研究では、臓器はより詳細に検索されたためであろう。>300mg/kg体重/日を投与された動物において、受胎率の低下と産仔の死亡を含む生殖影響が報告されている。
ラットに対する>5%LAS溶液の長期間経皮適用後およびモルモットへの60mg/kg体重の30日間の経皮適用後には、組織病理学的および生化学的変化が観察された。LASの≧0.3%溶液の経皮反復適用では、胎仔毒性と生殖影響が誘発されたが、母体毒性も誘発された。ヒトにおけるAOSの影響の評価を可能にする実験動物による研究から入手できるデータはほとんどない。
経口用量の250mg/kg体重/日を慢性的に投与されたラットにおいては影響は認められなかったが、母体毒性量の300mg/kg体重/日を投与されたウサギでは胎仔毒性が見られた。実験動物の皮膚および眼へのAOSの適用は、局所的な影響を誘発した。
数件の試験において、動物に対するASの短期および長期暴露の影響が検討されているが、それらの大多数は、不十分な組織病理学的検索や動物数の少ないこと、さらには長期試験に用いられた最高用量が毒性影響を形成しなかったため、NOAEL(no-observed-adverse-effect level)(無毒性量)の設定ができず妥当性を欠いている。しかし、ASを食餌中あるいは飲料水中に200mg/kg体重/日以上と同等濃度を投与されたラットでは、一貫して影響が報告されている。局所的な影響は、約0.5%以上濃度のASの適用により、皮膚および眼において観察された。高濃度においては、母体毒性および胎仔毒性影響が観察されている。
実験動物におけるLAS、AOS、ASの発がん性評価の長期試験は、その大多数は ①動物数が少ないこと ②用量の段階が少ないこと ③最大耐容量が得られていないこと ④組織病理学的検索が限定的であること、などの諸要素により不適切である。病理学的知見が十分に報告されている試験では、最大耐容量(maximal tolerated doses)が用いられておらず、その用量では毒性影響は得られていなかった。これらの限定が条件ではあるが、LAS、AOS、ASを経口的に投与した動物において、発がん性の証拠は得られていない。また、AOSの皮膚塗布による長期試験でも影響は示されなかった。
限られたデータに基づいた場合、これらの化合物はin vivo(生体内)およびin vitro(試験管内)において、遺伝毒性を示すようには見えない。
1.7 ヒトへの影響
皮膚貼付試験の結果は、ヒトの皮膚はごくわずかの刺激反応のみで、1%までのLAS、AOS、ASの24時間の接触に耐え得ることを示している。これらの界面活性剤は、皮膚表面の脱脂、自然の保湿成分の溶出、皮膚外層タンパク質の変性、外層の透水性と腫脹の増加を生じさせる。LAS、AOS、ASのいずれも皮膚感作(訳者注:過敏状態の誘発)を引き起こすことはなく、湿疹を発症するとの決定的な証拠はない。これらの界面活性剤の事故による摂取後において、重度の障害や死亡は報告されていない。
1.8 環境影響
1.8.1 直鎖アルキルベンゼンスルホン酸塩(LAS)
1.8.1.1 水生環境
LASについては、実験室(短期・長期実験)およびより現実的な条件[小規模・中規模の環境(micro- and mesocosm)および野外研究]の双方において、広く研究されてきた。一般的に、アルキル鎖の短縮あるいはフェノール基のアルキル基内部への移行(internalization)の増加にともない、毒性は減少する。魚類およびミジンコ(Daphnia)の観察では、1単位の鎖の短縮(例えば、C12からC11へ)は、毒性において約2分の1の減少を生じさせることを示している。
実験室の試験結果は次の通りである。
| - | 微生物:用いられた試験系の違い(例えば、活性化汚泥の阻害、混合培養および個別)により、結果は大幅に変わる。EC50(50%効果濃度)値は0.5mg/l(単一種)から>1,000mg/lまでの範囲である。微生物に対しては、鎖の長さと毒性との間に直線的な関連性はない。 |
| - | 水生植物:その結果は種類に大きく依存している。淡水生物のEC50値は、緑藻類では10~235mg/l(C10~C14)、藍藻類では5~56mg/l(C11.1~C13)、珪藻類では1.4~50mg/l(C11.6~C13)、大型植物では2.7~4.9mg/l(C11.8)であり、海洋性藻類の感受性はより高いと見られる。藻類においては、鎖の長さと毒性との間には直線的関連性はないであろう。 |
| - | 無脊椎動物:少なくとも22種の淡水種に対する急性L(E)C50[50%致死(効果)濃度]値は、軟体動物類では4.6~200mg/l(鎖長は特定せず、C13)、甲殻類に対しては0.12~27mg/l(C11.2~C18、鎖長は特定せず)、虫類では1.7~16mg/l(C11.8、鎖長は特定せず)、昆虫類に対しては1.4~270mg/l(C10~C15)である。昆虫に対する慢性L(E)C50値は2.2mg/l(C11.8)、甲殻類では1.1~2.3mg/l(C11.8~C13)である。甲殻類に対する慢性無影響濃度(no-observed-effect concentration:NOEC)(致死性あるいは生殖影響に基づく)は0.2~10mg/l(C11.8、鎖長は特定せず)である。海洋性無脊椎動物の感受性はより高いように見え、13種に対するLC50値は1mg/lから>100mg/l(ほとんどすべてはC12)で、試験された7種に対するNOECsは0.025~0.4mg/l(すべての試験について鎖長を特定せず)である。 |
| - | 魚類:21種の淡水魚に対する急性LC50値は0.1~125mg/l(C8~C15)で、慢性L(E)C50値は2種に対して2.4および11mg/l(C11.7、鎖長は特定せず)であり、NOECsは2種に対して0.11~8.4および1.8mg/l(C11.2~C13、鎖長は特定せず)である。ここでも、海洋性魚類の感受性はより高いように見え、6種に対する急性LC50値は0.05~7mg/l(C11.7、鎖長は特定せず)、慢性LC50値は2種に対して0.01~1mg/l(鎖長は特定せず)である。大多数の報告書では、鎖の長さの記載はない。海洋性生物種に対するNOECは<0.02mg/l(C12)と報告されている。 |
一般に市販品として用いられる製品の鎖の長さの平均はC12である。鎖の長さの違う多数の化合物がミジンコ(Daphnia magna)および魚類により試験されたが、他の淡水性生物類で試験された鎖の長さは通常C11.8である。C12LASに対する典型的なL(E)C50値は、ミジンコ(Daphnia magna)において3~6mg/l、淡水魚類で2~15mg/lである。また、典型的な慢性NOECsは、ミジンコ(Daphnia)で1.2~3.2mg/l、淡水魚で0.48~0.9mg/lである。この鎖の長さのLASに対する海洋性魚類の典型的な急性LC50値は<1~6.7mg/lである。
海水性生物類、特に無脊椎動物類は、LASに対して、淡水性生物類よりも感受性が高いように見える。無脊椎動物類においては、カルシウムに対するLASの隔離作用が、形態発生のためのこのイオンの利用性に影響を及ぼすのであろう。LASはイオン輸送に対して一般的な影響をもっている。LASの分解産物および副産物は、親化合物の毒性の10分の1ないし100分の1である。より現実的な条件下で得られた結果は次の通りである。
LASについては、湖沼における閉鎖状態(生物類が少ない)、生態系モデル(堆積物および水)、廃水処理施設の放出口の上流および下流、実験的流水を含む数種の栄養段階において、すべての淡水試験が実施された。ほとんどすべての場合にC12LASが用いられた。藻類は、冬季よりも夏季において感受性が高く、光合成後では3時間のEC50値は0.2~8.1mg/lであった。一方、生態系モデルにおいては、0.35mg/lにおいて藻類の集団個体群の相対的な量に影響は見られなかった。これらの研究における無影響濃度は、生物種と試験条件に依存し、0.24~5mg/lであった。これらの結果は、実験室の試験結果とかなりよく一致している。
1.8.1.2 陸生環境
植物類およびミミズについての情報は入手できる。肥料溶液中で試験された7種の植物のNOECsは<10~20mg/lであり、土壌中で成育に基づいて試験された3種では100mg/kg(C10~C13)であった。ミミズに対する14日間のLC50は>1,000mg/kgであった。
1.8.1.3 鳥類
ニワトリへの食餌中投与による1件の実験では、NOEC(卵の質に基づく)は>200mg/kgという結果が得られた。
1.8.2 アルファオレフィンスルホン酸塩(AOS)
AOSの、水生および陸生生物類への影響については、限られたデータしか存在しない。
1.8.2.1 水生環境
実験室での試験結果のみが入手できる。
| - | 藻類:緑藻に対するEC50値は>20~65mg/l(C16~C18)と報告されている。 |
| - | 無脊椎動物:ミジンコ(Daphnia)に対するLC50値は19および26mg/l(C16~C18)と報告されている。 |
| - | 魚類:9種の魚類に対する急性LC50値は0.3~6.8mg/l(C12~C18)である。ブラウントラウト(Salmo trutta)(訳者注:欧州北部の川に普通に見られるマス)、golden orfe(Idus melanotus)、harlequin fish(Rasbora heteromorpha)における短期実験では、C14~C16化合物の毒性はC16~C18よりも約5分の1と低く、それぞれのLC50値(すべての測定濃度において)は0.5~3.1(C16~C18)および2.5~5.0mg/l(C14~C16)である。ニジマスにおける2件の長期実験では、成育が最も敏感な指標であり、0.35mg/lのEC50を示している。海洋性魚類の灰色ボラ(grey mullet)(Mugal cephalus)では、96時間のLC50値は0.70mg/lであった。 |
1.8.2.2 陸生環境
肥料溶液中の植物についての1件の研究では、32~56mg/lのNOECsが示された。食餌中に投与されたニワトリの研究では、NOEC(卵の質に基づいた)として>200mg/kgが報告されている。
1.8.3 アルキル硫酸塩(AS)
1.8.3.1 水生環境
ASについては、短期および長期研究と、より現実的な条件下での1件の研究が行われている。ここでも、それらの毒性はアルキル鎖の長さに依存しており、直鎖および分枝ASとの間の毒性の差異についての情報は入手できない。実験室の試験結果は次の通りである。
| - | 微生物類:海洋性生物群集におけるEC50値は2.1~4.1mg/l(C12)であった。シュードモナス菌(Pseudomonas putida)(訳者注:緑膿菌。グラム陰性桿菌の一種で、水中・土中に非常に広く分布する)におけるNOECは35~550mg/l(C16~C18)であった。 |
| - | 水生植物類:EC50値は、緑藻類において>20~65mg/l(C12~C13)、大型植物では18~43mg/l(C12)であった。緑藻類におけるNOECsは14~26mg/l(C12~C16/C18)であった。 |
| - | 無脊椎動物:淡水種におけるLC50およびEC50値は4~140mg/l(C12/C15~C16/C18)、海洋種では1.7~56mg/l(すべてC12)であった。ミジンコ(Daphnia magna)における慢性NOECは16.5mg/l(C16/C18),海洋種では0.29~0.73mg/l(鎖長は特定せず)であった。 |
| - | 魚類:淡水種のLC50値は0.5~5.1mg/l(C12~C16、鎖長は特定せず)、海洋種では6.4~16mg/l(すべてC12)であった。長期実験の結果は入手できない。 |
これらの実験の多くは、静的条件下で実施されたことに留意すべきである。ASは容易に生分解されるため、それらの毒性は過小評価されているであろう。メダカ(Oryzias latipes)を用いた48時間の実験では、C12、C14、C16の化合物に対するLC50値は、それぞれ46、2.5、0.61mg/l(実測値)であった。これと他の実験では、鎖の長さの2単位に対し毒性は5倍の差を生じることを示している。C16~C18を有する化合物の流水試験では、0.55mg/lのNOECが認められた。
1.8.3.2 陸生環境
ミミズおよびカブラ(植物)に対するNOEC値は、>1,000mg/l(C16~C18)が報告されている。
1.9 ヒトの健康リスクの評価
LASは洗浄剤および洗濯用品中の界面活性剤として、最も広く使用されており、AOSおよびASも洗浄剤および個人衛生用品に用いられている。したがって、ヒトの暴露の主要経路は皮膚接触を通してである。少量のLAS、AOS、ASは、飲料水から、また、家庭用品や食品中の残留物として摂取されるであろう。入手し得る情報は限られているが、これらの媒体を介してのLASの1日摂取量は1人当り約5mgと推算されている。LAS、AOS、ASの職業暴露は各種製品の製剤中において起こるであろうが、これらの化合物へのヒトの慢性暴露の影響について入手し得るデータはない。
LAS、AOS、ASは、未希釈の製品と同程度の濃度に、反復あるいは長時間接触後では皮膚を刺激する。モルモットにおいては、AOSはγ-不飽和スルトン(訳者注:環状スルホン酸エステル)が約10ppm以上の場合には皮膚感作を誘発する。
入手し得る実験動物の長期実験は、実験計画、少数の使用動物数、不十分な用量による試験、限られた組織病理学的検索などの要素のため、LAS、AOS、ASの発がん性評価には不十分である。LAS、AOS、ASを経口投与された動物による少数の入手し得る実験では、発がん性の証拠はなく、AOSを皮膚塗布により投与された長期実験の結果も陰性であった。報告された実験数は少ないが、これらの化合物はin vivoあるいはin vitroにおいて遺伝毒性を示すようには見えない。
LASを食餌または飲料水中に、約120mg/kg体重/日の量と同等の濃度を投与されたラットの亜慢性実験では、肝臓における生化学的および組織病理学的変化を含むごく軽度の影響が報告されているが、これより高用量をより長期間暴露された動物においては何の影響も認められなかった。LASの経皮適用は、全身毒性および局所的影響の双方を生じさせた。
一般集団におけるLASの1日平均摂取量は、飲料水、家庭用品、食品を介しての暴露についての限定的な推算に基づいた場合、実験動物において軽微の影響の誘発を示すレベルよりはずっと低い(約3桁少ない量)と推定される。
ヒトにおけるAOSの影響は少数の研究で入手でき、それらはLASに暴露された動物の場合と類似している。一般集団によるAOSの1日平均摂取量の推算や、ヒトおよび動物に影響を誘発するレベルについてのデータ不足のため、環境中のAOSへの暴露がヒトの健康にリスクをもたらすかどうかについて、確実な評価をすることはできない。しかし、AOSの使用量はLASより少ないため、ヒトが暴露される媒体中のAOSレベルはLASより低いであろう。
ラットに対し、食餌あるいは飲料水中における200mg/kg体重/日以上と同等以上の濃度のASのラットを投与した少数の実験において、一貫性のある影響が報告されている。反復あるいは長時間の局所への適用後には、眼および皮膚に限局性の影響が認められている。入手し得るデータでは、一般集団によるASの一日平均摂取量の推算には不十分である。しかし、AS界面活性剤はLAS含有のものほど広くは使用されていないため、ASの摂取は動物において影響を誘発する量よりも3桁は少ないであろう。
1.10 環境影響の評価
LAS、AS、AOSは大量に使用され、廃水を通じて環境中に放出される。リスクアセスメントには、暴露濃度と有害影響を生じさせない濃度との比較が必要であり、これはいくつかの環境媒体において実施されている。陰イオン系界面活性剤では、一般に、最も重要な環境媒体は、下水処理施設、表層水、堆積物、汚泥施用土壌、河口域、海洋環境である。生分解(初期および最終的の)と吸着が起こり、環境中濃度と生物学的利用能の減少が生じる。鎖の長さの短縮と親化合物の構造の喪失の双方は、親化合物よりも毒性の低い化合物を生成する。実験室試験の結果と環境への影響を比較する場合には、これらの考察を考慮に入れることが重要である。さらに、これら3種の陰イオン系化合物の環境暴露関連のリスク評価では、鎖長の同じ化合物の毒性についての試験結果を比較すべきである。
水生生物類に対するLASの影響は広く試験されている。淡水による実験室試験では、魚類は最も感受性の高い種であり、コイに対するNOECは約0.5mg/l(C12)で、これらの結果は、より現実的な条件下で確認されている。しかし、植物性プランクトンにおいては差異が認められており、その3時間の急性試験ではEC50値は0.2~0.1mg/l(C12~C13)であったが、一方、他の試験では0.24mg/l(C11.8)において多くの場合に無影響を示した。海洋種の感受性は、他の分類に属する生物種よりもわずかに高いように見える。
LASの広汎な測定で示される通り、環境中におけるこれら3種の陰イオン系化合物の濃度は広範囲にわたっている。この広範囲のため、これらの化合物に対する一般的に適用し得る環境リスクアセスメントは存在しない。リスクアセスメントには、重要な生態系における暴露と影響濃度の適切な知識が含まれるべきである。
環境リスクアセスメントを実施する以前に、ASおよびAOSの暴露についての正確なデータが必要である。そのため、受け入れ環境媒体における暴露濃度評価にモデルが用いられる。水生生物類に対するASおよびAOSの毒性データ、特に安定濃度への慢性暴露後についてのデータは比較的少ない。入手し得るデータは、AOSおよびASの毒性は、他の陰イオン系界面活性剤に類似していることを示している。
これらの化合物に対して、海水性生物は淡水性生物よりも感受性が高いように見えるが、それらの濃度は、廃水放出口の近くを除き、海水中では低い。海水の汚泥中のこれらの化合物の環境中の運命(fate)と影響は詳細には検討されていない。
LAS、AOS、ASのような界面活性剤の環境中の安全を評価するため、実際の環境濃度と無影響濃度とを比較すべきである。化学物質の本質的特性のみでなく、その消費のパターンあるいは傾向の研究が必要である。これらは地域により大幅に変わるため、地域毎のアセスメントと評価を実施すべきである。
1.11 ヒトの健康と環境の保護のための勧告
- 作業場においては(製造および製剤工程において)粉塵への暴露が起こるため、作業者の健康の保護を確実にするため、職業衛生規範を適用すべきである。
- 消費者および工業的用途のための製剤化、特に手による洗浄や洗濯に用いられる製剤は危険を避けるよう考えるべきである。
- 関連する環境媒体への過負荷の初期の徴候を得るために、環境の暴露と影響を適切にモニターすべきである
1.12 今後の研究に対する勧告
ヒトの健康
- ヒトに対するLAS、AOS、ASの暴露の主要経路は皮膚であるが、実験動物における皮膚毒性および発がん性についての十分な長期実験は入手できないため、これらの化合物の皮膚適用による適切に計画された長期実験の実施を勧告する。
- AOSおよびASの遺伝毒性についての確定的なデータはないため、in vivoとin vitroにおける追加実験を実施すべきである。
- 生殖および発生毒性について入手できる実験は不適切である点に鑑み、影響データと、LAS、AOS、ASの影響発現量および無影響量を得るため、実験動物における確定的な実験を実施すべきである。
- LAS、AOS、ASの暴露は十分に解明されていないため、一般集団の暴露、特にこれらの界面活性剤が手による洗浄や洗濯に用いられる場合についてモニターすべきである。
- LAS、AOS、ASは、環境媒体中の他の化学物質の移動を増強し、ヒトが暴露される表層水、河川堆積物、土壌中のそれらの生物学的利用能と毒性を変化させるため、他の環境中化学物質との相互作用とヒトに対する影響を検討すべきである。
環境の安全
- AOS、ASの吸着および脱着のメカニズムについての追加研究を実施すべきである。水中における溶存および懸濁コロイド微粒子との間のLAS、AOS、ASの分配についての研究も実施すべきである。収着係数の数学モデルを、物理-化学的パラメータに基づいて開発し、正当性を確認すべきである。
- 暴露が発生した場合には、汚泥適用の土壌と河川堆積物におけるAOSとASの生分解の研究を実施すべきである。河川堆積物(好気性および嫌気性地域)の研究は、処理済・未処理の廃水および汚泥の放出口の下流において実施すべきである。
- 暴露についての情報を得るため、LAS、AOS、ASの環境濃度について、地域的また国家的のモニタリングを実施すべきである。関連する環境媒体中において、低濃度のASOおよびASを検出するため、分析方法を開発すべきである。
- これらの界面活性剤の放出の影響評価を促進するため、廃水と河川中のLAS、AOS、ASの濃度、種類、廃水処理施設の効率と所在について、国としてのデータベースを開発すべきである。
- 魚類および無脊椎類動物に対するAOSおよびASの毒性の長期実験(淡水および海水による)を実施し、これらの生物種の相対的感受性を実証すべきである。
|
|