遺伝毒性概要
国立医薬品食品衛生研究所・変異遺伝部
前部長 本間正充
(本遺伝毒性概論には筆者の持論も含まれており、国内外のガイドラインや、一般的な考えとは異なる場合もあります。)
1. はじめに:遺伝毒性とは何か?
遺伝毒性(Genotoxicity)とは、外来性の化学物質や物理化学的要因、もしくは内因性の生理的要因などによりDNAや染色体、あるいはそれらと関連するタンパク質が作用を受け、その結果、細胞のDNAや染色体の構造や量を変化させる性質(事象)をいう。遺伝毒性は他の毒性と異なり、それ自体に毒性の実態はない。肝毒性、神経毒性、発がん性などは症状や病変として認識できるが、遺伝毒性自体の症状や病変はない。体細胞にこれら事象が起これば、がん化の引き金となり、生殖細胞に起これば次世代につながる遺伝病の原因となりうる。従って遺伝毒性とはそれら疾患を引き起こす潜在的性質(メカニズム)の一つであり、その性質は一般的に遺伝毒性試験によって評価される。直接的に物質とDNAとの相互作用を測定し、評価することもあるが、相互作用の結果に生じたDNA損傷、DNA損傷応答、DNA修復反応、遺伝子突然変異、染色体異常などを測定して調べることが一般的である。遺伝毒性とは別の言葉として変異原性(Mutagenicity)がある。
Organisation for Economic Co-operation and Development(OECD:経済協力開発機構)では化学物質がヒトの健康や生態に及ぼす影響を評価するための試験法を定めている(OECDテストガイドライン)。OECDは2015年まで変異原性の定義として「細胞あるいは生物の遺伝物質(DNA、染色体)の量、あるいは構造の恒久的、かつ次世代の細胞に伝達可能な変化の誘発を示し、これらの変化は、単一の遺伝子、あるいは遺伝子の一部、遺伝子群または染色体レベルにまで及ぶ」とした。この定義は多くのwebsiteでも採用されている(https://www.chemsafetypro.com/Topics/CRA/Mutagenicity_and_Genotoxicity.html)。 2010年からOECDの遺伝毒性専門家会議で”Introduction to the OECD guidelines on genetic toxicology testing and guidance on the selection and application of assays”の策定作業が開始され、2016年、OECDは”Overview of the set of OECD genetic toxicology test guidelines and updates performed in 2014-2015”を発表した(何故タイトルが変更されたのかは不明)(文献1)。このOverviewでは変異原性の新たな定義として、(1)単一の遺伝子あるいは遺伝子の一部、遺伝子群または染色体レベルの変異に加えて、(2)染色体の安定的な(次世代の細胞に受け継がれる)欠失、重複、または再構成を導くような染色体の切断、(3)2倍体である染色体数を変化(増加または減少)させるような異数性、(4)体細胞組み換え、としている(文献2)。しかしながら、これら4つの定義は互いに矛盾を含んでいる。たとえば、(2)の染色体の切断は恒久的かつ次世代に伝達可能な変化ではない。(3)の染色体の異数性は染色体全体からなる小核の発生を意図しているが、小核もまた、恒久的かつ次世代に伝達可能な変化ではない。また、(4)の体細胞組み換えは変異を引き起こすメカニズムの一つ(組み換え修復)であり、最終的に引き起こされる変異は(1)に含まれる。このように2016年のOECDの遺伝毒性Overview文書での変異原性の定義は問題が多く、混乱を引き起こしている。これは、染色体異常や小核の形成を変異原性と見なしたいとする一部の専門家の間違った考え方に基づいているためである。変異原性は試験によって定義されるものではなく、あくまでもメカニズムによって定義されるべきである。その一方、このOverviewではどの試験が変異原性試験に該当するかを明示していない。そのため、化学物質の変異原性を評価するためのバッテリー試験やフォローアップ試験は各局、各ガイドラインでばらばらで統一化されていない。
筆者は変異原性の定義として「細胞あるいは生物の遺伝物質(DNA、染色体)の量、あるいは構造の不可逆的かつ永続的な変化の誘発であり、変異原性物質とは、その物質もしくその代謝物が、DNAと直接作用することにより、これらの変化を誘発する物質」と定義する。単純に言えば、変異原性の実態は突然変異(Mutation)誘発性である。日本環境変異原学会のHPにある用語の解説でも変異原性とは「一般的には、化学物質による突然変異誘発作用をいう」としている(http://www.j-ems.org/info/glossary.html#ha)。ここでの突然変異は、点突然変異だけを意味するのでは無く、欠失、挿入、増幅、転座などの染色体レベルの大きな変異も含む。これら変異を引き起こす物質が変異原性物質(Mutagen)である。細菌や細胞で突然変異誘発性が示された変異原性物質は必ずしも発がん物質であるとは言えないが、哺乳類動物のin vivoで突然変異誘発性が認められた場合は、発がんリスクは必ずあると考えてよい。
一方、遺伝毒性は変異原性に比べ広義であり、DNAや染色体に影響を与え、構造もしくは遺伝情報の変化をもたらすが、変異原性のように次の世代の細胞ゲノムに不可逆的変化を与えないものまで含む(図1)。遺伝毒性があるが、変異原性が認められないものはDNAに対する誘発損傷の徴候ではあるが、がんや遺伝病を引き起こす遺伝子変化の直接的証拠ではないため、その重みは低い。従って、遺伝毒性が関連するリスク評価においては両者を区別することが重要である。
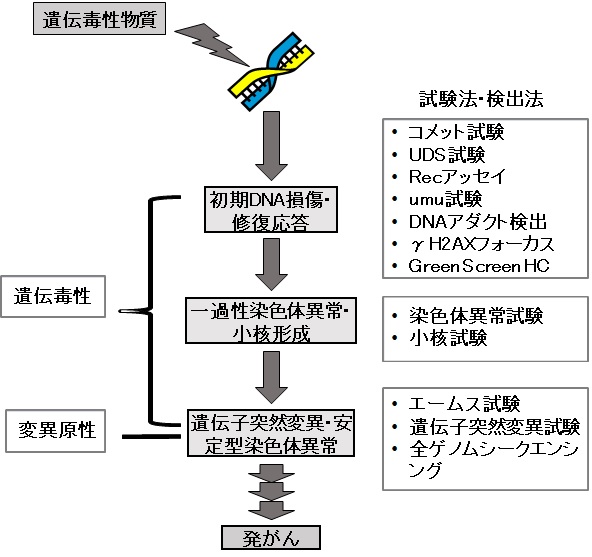
図1.遺伝毒性・変異原性とその試験法
染色体異常誘発性(Clastogenicity)という用語は、染色体の構造異常を生じさせる因子に対して用いられる。染色体異常誘発因子は、染色体DNAと染色体の切断(Break)、または交換(Exchange)をもたらす染色体の切断を引き起こす。染色体異数性誘発性(Aneugenicity)は、細胞における染色体数の変化(増加あるいは消失)を起こす因子の作用を指す。異数性誘発物質は、正常では46本の染色体からなるヒト二倍体染色体細胞に対して特定の染色体の消失または増加を引き起こす可能性がある。しかしながら、ClastogenicityやAneugenicityという用語は、一般には後述する染色体異常試験や小核試験に用いる用語であって、その現象の多くは一過性で有り、実際のがんや遺伝病で観察される安定型の染色体異常を表す用語ではない。特に染色体異常試験や小核試験で観察されるAneugenicityはDNAとの直接作用よりもむしろタンパク質である細胞分裂装置への作用の結果とみるべきである。従って、メカニズムを考えると遺伝毒性や変異原性に含めるべきではない。
以上のことから筆書は遺伝毒性物質、変異原性物質、および非遺伝毒性物質を以下のように定義する。
●遺伝毒性物質: その物質自体、もしくは代謝物がDNAに直接作用し、DNA損傷を引き起こす物質。変異原性物質を含む。
●変異原性物質: その物質自体、もしくは代謝物がDNAに直接作用し、DNA損傷を引き起こし、その結果、ゲノムDNAに不可逆的かつ次世代の細胞に伝達可能な変化(突然変異)をもたらす物質。
●非遺伝毒性物質: DNAとは直接作用しない物質、もしくはその代謝物。非遺伝毒性物質の一部は染色体異常試験、小核試験等で陽性を示すものがある。異数性誘発物質等が相当する。
2. 遺伝毒性の発現様式
遺伝毒性は、損傷を受けたDNAが、DNA修復反応を受け、一過性のゲノムの変化を経て、最終的に不可逆的な遺伝子突然変異をもたらす一連の発現様式を持つ。
2.1. DNA損傷
DNA損傷の外的要因としては物理的要因と化学的要因に分類できる。物理的要因としては、太陽光線中に含まれる紫外線や、X線、γ線などの電離放射線などが挙げられる。紫外線は主として、隣接するピリミジン同士の共有結合を形成し、シクロブタン型ピリミジン二量体や、(6-4)光産物などをDNAに形成する。電離放射線はさまざまなタイプのDNA損傷を引き起こすことが知られているが、主要な損傷としてはDNAの一本鎖および二本鎖切断がある。特に二本鎖切断は、最も危険性の高いDNA損傷であり、致死的であるか、もしくはがん原性の高い染色体レベルの突然変異を引き起こす。これら以外にも、ラジカルの発生により、8-オキソグアニンやチミングリコールなどの塩基の酸化修飾などのDNA損傷を引き起こす。一方、化学物質によるDNA損傷(修飾)は化学物質の種類や反応性の程度により多種多様である(文献2)。対象となる化学物質自体が直接DNA に作用する場合と、その化学物質が、肝臓などに存在する薬物代謝酵素によって代謝活性化されてDNA に損傷を与える場合がある。これらDNA反応性化学物質の多くは求電子性を示し、共有結合による付加体を形成する。突然変異と関係が深いものとしては、メチル化剤、エチル化剤によるDNA塩基のアルキル化、マイトマイシンCなどによる隣接した塩基間での架橋形成などがあげられる。発がん物質として有名であるベンゾ[a]ピレンやアフラトキシンなどは代謝活性化を受けて、大きな付加体を形成する。付加体の多くはDNA修復機構によって取り除かれるが、これら付加体はDNAポリメラーゼを阻害し、複製時に誤りを起こし、その結果、突然変異を引き起こしやすい。
DNA損傷はこのような外的要因だけでなく、細胞内で生じる通常の代謝によっても生じ、その数は1日1細胞中において数百とも言われている(文献3)。このようなDNA損傷は自然突然変異や、細胞老化の主たる要因であると考えられている。DNA損傷を引き起こす細胞活動には、酸素代謝があり、酸素の消費により反応性の高い活性酸素種が8-オキソグアニンやチミングリコールなどのDNA損傷を引き起こす。その他のDNA損傷としては塩基の脱離や脱アミノ化などDNAの化学的不安定性に由来するものなどがある。また、特に損傷を伴わないが、DNA複製時にはDNAポリメラーゼによる複製エラーが高頻度に起こっていることが知られており、これが自然突然変異の大きな要因となっている。
2.2. DNA修復
ヒトを含む生物は細胞内のDNAの非常に広範囲にわたる損傷を効率的に修復するための様々な対抗措置を進化によって獲得してきた。一般的には、2つの過程がある。損傷が広範囲で重篤である場合、細胞はアポトーシスを起こし、細胞が変異細胞に変化しないように、生体内から効率的に除去される(文献4)。一方、損傷が軽度である場合、細胞では一連のDNA修復作業が行われる。これは、細胞内DNA損傷反応ネットワークの一部であり、このネットワークにより損傷DNAを非損傷状態に回復させるか(エラーのない修復)、もしくは修復したが、結果として突然変異を形成した状態で回復させる(誤りがち修復)。このDNA修復機構は、DNA損傷の種類に応じてさまざまな種類が存在し、そのほとんどは全ての生物に共通であることが知られている。以下に主な修復機構の概要を紹介する。尚、2015年のノーベル化学賞はDNA修復機構の研究で多大な貢献をしたポール・モドリッチ博士(ミスマッチ修復)、トーマス・リンダル博士(塩基除去修復)、アジス・サンカー博士(ヌクレオチド除去修復)に授与された。以下に紹介するこれら修復機構の発見は、遺伝性疾患を始めとした様々な病気のメカニズム理解や、その治療法の開発に重要な知見を与えた(文献5)。
2.2.1. 復帰型修復
DNA損傷を酵素反応により元通りにする最も単純で効率的な修復機構である。代表的なものとしては、紫外線によって生じたピリミジンダイマーや(6-4)光産物を、光エネルギーを利用して元どおりの塩基に復帰させる光回復酵素による修復がある。この酵素はバクテリア、一部の動物、植物に存在するが、ヒトでの存在は確認されていない。アルキル化剤によってメチル化されたDNAはO-6 メチルグアニンDNAメチル転移酵素(MGMT)によって脱メチル化される。O-6 メチルグアニンは突然変異を起こしやすく、MGMTの主な役割は、単純なアルキル化剤から細胞を保護することである。
2.2.2. ミスマッチ修復
ミスマッチ修復(Mismatch repair; MMR)は、DNA 複製や相同組換えの際に生ずる誤った対合(ミスマッチ)を修復する機構である。哺乳類細胞においては、MMRは2種類存在する。1つは、塩基置換や1~2塩基の短いループ構造を持つミスペアを修復する機構で、これら構造は、MSH2とMSH6の複合体によって認識され、MLHlとPMS2がその部位に動員され、それに引き続いて、除去、DNA合成、結合などの段階が開始され、修復される。もう一つは反復配列における複製機構のずれや、組み換えのエラーによって生じた大きなループ構造を持つミスマッチに対する修復機構で有り、このようなループ構造はMSH2とMSH3複合体によって認織された後、MLHl/MLH3複合体が組み込まれ、次の段階の修復機構が促進される。
MMRの研究から、MMR遺伝子の変異とゲノム不安定性との関連が明らかになった。遺伝性非腺腫大腸がん(HNPCC)患者の多くはマイクロサテライトとして知られる単純な反復配列頂域で、多くの変異が観察され、このような遺伝的不安定性が、がんの素因と考えられている。また、HNPCC患者の85%は、MHL1あるいはMSH2遺伝子に変異をもつことから、その遺伝的不安定の原因は、MMR遺伝子の変異にある。このように、がんの発生・進展において直接的に重要な役割を果たす遺伝子変異を「ドライバー遺伝子変異」という。
2.2.3. 塩基除去修復
MMR経路が主にDNA複製後のエラーの検出と修復に働くのに対して、除去修復機構は、主として外的あるいは内的なDNA損傷作用によって生じた異常に対応する。塩基除去修復(Base excision repair; BER)は、酸化DNA 損傷(8-オキソグアニン)やアルキル化損傷、またシトシンの脱アミノ化により生じたウラシルなどが標的となる。多くの場合、これらの塩基損傷は修復されないと点突然変異を引き起こす。たとえば、8-オキソグアニンは、チミンと類似し、安定な8-オキソグアニンとアデニンの対を形成し、複製型DNAポリメラーゼによる校正からすり抜けるとG→Tトランスバージョンが生じる。BERはDNA グリコシラーゼ(OGG-lやMUTYH)が損傷塩基を認識して除去することから始まる。これらは、1秒間に数百万塩基対のスピードで損傷をスキャンし、損傷部の塩基をDNA骨格から切り取って脱塩基部位を形成する。脱塩基部位はポリ(ADPリボース)ポリメラーゼ(PARP)とXRCC1とともに、APEエンドヌクレアーゼによって認識される。一塩基のギャップを DNAポリメラーゼβが埋め、最後にDNAリガーゼIIIがDNA鎖を連結させる(図2)。BERはゲノム安定性の維持に重要であるにもかかわらず、その関連遺伝子の変異によるヒト疾患や、遺伝性がん素因症候群はまだ報告されていない。
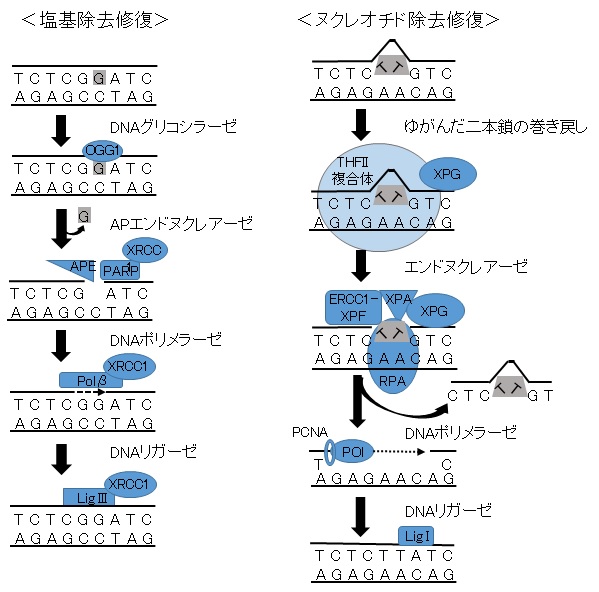
図2.塩基除去修復とヌクレオチド除去修復
2.2.4. ヌクレオチド除去修復
ヌクレオチド除去修復 (Nucleotide excision repair; NER)は、紫外線よって誘発されたピリミジン二量休や、ベンゾ[a]ピレンなどの発がん物質によって生じる大きなDNA付加体のようなDNAのらせん構造にゆがみを与えるような損傷の除去に働くDNA修復系である。真核生物においてはNERに関与するタンパクは30種類以上同定されており、それらは損傷の認識、切除、除去、修復合成、および結合の一連のプロセスを奏でるオーケストラのように振る舞う。NERの構成因子はヒトの色素性乾皮症(Xeroderma pigmentosum; XP)と、コケイン症候群(Cockayne; CS)の細胞を使って次第に分かつてきた。XPは紫外線感受性で皮膚癌になりやすい遺伝的素因をもち、少なくとも7つの異なった相補的遺伝子群が存在する。NERには2種類の異なった機構がある。一つはゲノム全体を探索してDNAのらせん構造にゆがみを見つけるヌクレオチド除去修復(Global genome repair; GGR)。もう一つ転写共役型で、転写を妨げる損傷に対応したヌクレオチド除去修復である(Transcription-coupled repair; TCR)である。NERと転写との聞に関係があることは興味深いことであり、活発に転写が行われている遺伝子内で、特に転写側のDNA鎖内の損傷が、他のゲノムでのDNA損傷に比べて優先的に速く修復される。XP遺伝子はGGRに関与するのに対して、CS遺伝子はTCRにおけて特異的な役割を果たす。それに引き続くNERの過程は両者で似ており、DNAはXPタンパクを含むTFIIH複合体によって損傷部位周辺で局所的にゆがみが解消される。ゆがみが解除されるとXPAと複製タンパク質A (RPA)が、開いた中間体を安定化し、異常部位を除去するERCC1/XPF工ンドヌクレアーゼを動員する。その後、 DNAが合成され、連結されることによって、修復が完了する(図2)。NERが欠損した患者は太陽光への感受性が高く、また皮膚がんリスクが1,000倍以上に増えることが知られている。
2.2.5. DNA二本鎖切断修復
放射線等のDNAの二本鎖切断(Double strand break; DSB)は、最も重篤なDNA損傷であり、ゲノム恒常性の維持の驚異となる。DSBはDNA複製の際の複製フォークの停止部位、一本鎖切断部位の複製の際などにも発生する。DNA切断の修復を媒介するングナル伝達経路の活性化には、 PI(3)K様キナーゼであるATMとATR がかかわる。DSBはATMを活性化し、複製フォークの停止における一本鎖切断はATRを活性化する。これらタンパク質の活性化は、ヒストンH2AXを含む多くの標的をリン酸化し、クロマチン構造の局所的な変化をもたらす。ATMとATRの下流の標的にはチェックポイント介在タンパク質(CHK)があり、ATMは主にCHK2を活性化し、ATRはCHK1を活性化する。ATR/CHK1とATM/CHK2は、p53をリン酸化、CDC25Aの抑制を介し、アポトーシスの誘導、細胞周期の遅延、DNA 修復の亢進を行う。こうしたDNA 損傷により誘発されるシグナル伝達の経路をDNA 損傷応答と呼び、この経路に関与するタンパク質は、センサー(ATM、ATR など)、トランスデューサー(CHK1、CHK2 など)、エフェクター(CDC25Aなど)に分類される。DSBの修復そのものは、MRE11/RAD50/NBS1構成されるMRN複合体によってDSBが認識されることによって開始される。この修復過程は酵母からヒトに至る広範囲の種でほぼ類似しているが、最も多用される過程は動物種によって異なる。相同組換え(Homologous recombination; HR)と、非相同性末端再結合(Non-homologous end joining; NHEJ)が一般的な過程があるが、酵母ではHRが、哺乳類細胞ではNHEJが優先してDSBが働く(図3)。以前は、HRとNHEJは基質であるDSBに競合的に働くと考えられてきたが、現在では状況に応じて協力的に働くものと考えられている。
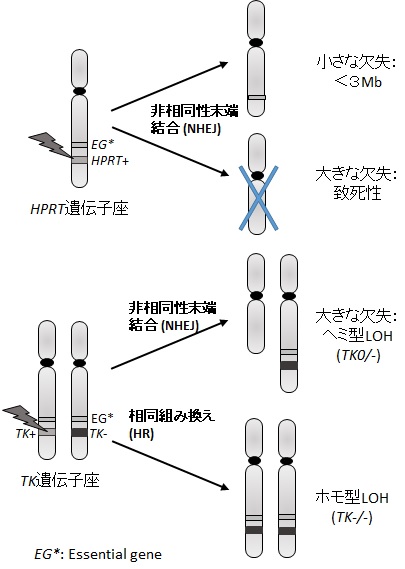
図3.DNA二本鎖切断修復とLOH
2.2.5.1. 相同組み換え修復(HR)
HRによる修復は、DNA 合成後の姉妹染色分体間で起こるため、DNA複製の際の複製フォークの停止部位や、一本鎖切断部位で生じたDSBに主に働く。切断により生じたDNA 断片由来の単鎖DNA が3'─末端側から挿入し(D ループ構造)、相補鎖を鋳型にDNA合成を行う。MRE11/RAD50/NBS1 複合体は、DNA鎖切断の認識、DNA 鎖の切断末端に結合して5' → 3' にDNA 鎖を削って3'─末端を突出させる際に役割をはたしていると考えられている。RAD51 はBRCA1/2と複合体を形成し、DNA 断片と相同な姉妹染色分体上の配列を検索し、D ループの形成を促進する。その後、RAD51はDNA二本鎖内の一本鎖と別の一本鎖配列との相同配列を交換し、ホリデイジャンクション(Holiday junction; HJ)よばれる相同組換えにより形成される交叉(中間体)を形成させる。最後にリゾルベースがこのHJ構造を乖離させ、エラーのない2コピーの完全なDNA分子が形成される。HRは姉妹染色分体間で起こる限り、エラーのない理想的な修復経路である。
2.2.5.2. 非相同性末端再結合(NHEJ)
DSBの修復のもう1つの経路がNHEJである。NHEJはDSBの末端同士が結合するので、HRができないG1(G0)期におけるDSBの修復は、もっぱらこの機構に依存する。従って、放射線等の外来性因子によるDSB損傷にはNHEJが働く。NHEJは、結合部に必ず欠失等の変異もたらすエラー発生型の修復機構である。しかしながら、NHEJによる欠失は比較的小規模で有り、エラー発生型でありながらゲノムの安定維持に貢献しているものと考えられる。NHEJの過程は、切断されたDNA末端が、Ku70/Ku80のヘテロ二量体によって認識されることから始まる。これはDNA依存性プロテインキナーゼと、ヌクレアーゼであるアルテミスを動員する。その後、XRCC4とDNAリガーゼIVを含む複合体によって結合される。NHEJは正常リンパ球の成熟過程で起こるV(D)J組み換えと、クラススイッチにも関与している。NHEJ、V(D)J組み換えの結合末端には正確な結合を可能とするための短い相同領域(Microhomology)がのりしろのように存在することが多い。
2.2.6. 損傷乗り越え複製反応
損傷乗り越え複製(Translesion DNA synthesis; TLS)は、損傷DNAを鋳型に強行的に複製を行う機構である。ポリメラーゼ活性を持つ酵素の他に、ユビキチン化に関わる酵素やDNAの滑る留め金として働くPCNAが関与する。鋳型DNA 鎖上の損傷を乗り越える際に正しい塩基を挿入すれば損傷は修復され、誤った塩基を挿入は突然変異を引き起こす。また、損傷部位でのTLS機構の停止は、染色体異常や細胞死をもたらすことが知られている。従って、TLSはDNA 損傷に基づく突然変異の抑制と誘発に重要な役割をはたしている。
2.3. 一過性のゲノム変化・異常
損傷を受けたDNAが、DNA複製後、細胞分裂の前にM期を迎えると、様々な染色体の異常が観察される。染色体異常は、染色体の構造異常と染色体の数の異常に分けられる。構造異常は、さらに染色体型異常(Chromosome-type)と、染色分体型異常(Chromatid-type)に分類される。G1 期に細胞がDNA損傷を受けると染色体型異常が起こり、S 期およびG2 期では染色分体型異常が誘発される。これら染色体、染色分体異常は一過性の染色体の形態的変化であり、DNAレベルではこのような変化は認識されない。このような一過性の染色体の形態的変化を持つ細胞の多くは、生き残る可能性は少なく、次第に細胞集団から排除され、最終的にはそのような染色体異常は観察されなくなる。従って、厳密に言うと、このような染色体異常は非永続的であり、変異原性とは言えない。しかしながら、一過性の染色体の形態的変化であっても、その一部は、がん細胞や遺伝病で観察される染色体異常の原因になりうるとの主張もあり、現在では、染色体異常試験で観察される染色体、染色分体異常は変異原性に分類されることもある。
染色体異常として観察される無動原染色体断片は、中間部欠失、末端部欠失、及び二動原体染色体や環状染色体の形成により生じる。細胞分裂後期から終期に無動原染色体断片が娘核に入らなかったり、または分裂後期にすべての染色体が両極に分かれることができなかったりすると、細胞質中に小核(Micronucleus)が形成される。小核も染色体異常と同様に一過性の変化であるが、染色体異常と異なり、小核をもつ細胞の全ては最終的には集団から消失する。従って、小核の形成は変異原性ではないとするのが妥当である。
一方、染色体数の異常は、直接的なDNA損傷に起因するものではないと考えられており、これについては事項で述べる。
2.4. 遺伝子突然変異・安定型染色体異常
DNA損傷に対して、DNA修復機構が適切に働かなかった場合や、修復の誤りは最終的にゲノム中に不可逆的、かつ永続的な安定型の突然変異をもたらす(変異原性)。この突然変異は、一般に、塩基配列レベルでの変異を指標にした遺伝子突然変異と、染色体レベルでの大きなゲノム変異に分けられる。遺伝子突然変異は、塩基置換やフレームシフト変異などの比較的小さな変異を対象とする点突然変異と、より大きな変異(欠失、挿入等)に分けられる。塩基対置換とは、正しいヌクレオチドのところに誤ったヌクレオチドが置き換わることである。塩基対置換には、プリン塩基(アデニン、グアニン)からプリン塩基、あるいはピリミジン塩基(シトシン、チミン)からピリミジン塩基への変異を表すトランジションと、プリン塩基からピリミジン塩基あるいはピリミジン塩基からプリン塩基へ置換するトランスバージョンがある。フレームシフト変異は、1〜2 塩基の欠失あるいは付加により、mRNA からタンパク質への翻訳の際の枠組み(アミノ酸は3 塩基ずつのコドンにより指定されている)がずれることにより遺伝子機能が不活化する変異である。点突然変異はわずか1塩基の変化であるが、それにより翻訳されるタンパク質の機構が消失したり(がん抑制遺伝子)、逆に機能が活性化したり(がん遺伝子)する場合があるので、突然変異のサイズが毒性に比例するわけではない。
電離放射線の暴露により染色体異常形成を誘発するDNA修復の誤りは、DSBの誤った結合、あるいは同時に起こっている他の損傷に対する修復機構の相互作用により起こる。その結果、修復時に染色体断片が誤って再結合することによる染色体内変異(欠失や逆位)、あるいは染色体間変異(二動原体、転座など)を引き起こす。二動原体染色体は、細胞分裂の際に、姉妹セントロメアが対極の中心体に引っ張られるために架橋を形成し、これは分裂後再びDSBをもたらす。これを、切断-融合-架橋 (Breakage fusion bridge; BFB)サイクルという(図4)。このBFBサイクルが染色体不安定性を拡大し、染色体の転座、増幅、欠失を引き起こし、最終的はゲノム中に複雑な染色体異常を引き起こす(文献6)。これまで、細胞にがん化には1つの細胞に異なったタイプの変異が時聞をかけて蓄積し、それらががん細胞へと形質転換を引き起こすと考えられてきたが、最近の研究では、たった1つ損傷(変異)が発がんに至る複数の変異を一気に引き起すようなゲノムのカタストロフィ現象が報告されている。このカタストロフィは染色体を破砕し、たくさんのゲノム再編成をもたらすのでクロモスリプシス(Chromothripsis)と呼ばれている(文献7,8)。クロモスリプシスの原因はまだよくわかっていないが、先に説明した切断-融合-架橋サイクル、染色体の断端結合を引き起こしうるテロメアの機能不全、アポトーシスの不完全停止による染色体異常細胞の存続が関与していると考えられる。
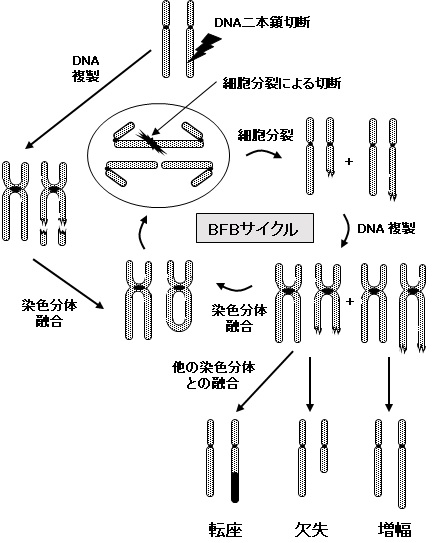
図4.Breakage-Fusion-Bridge (BFB)サイクルによる染色体異常の誘発
DSBはエラーフリー型修復であるHRが正しく働いた場合でも突然変異をもたらす。HRはDNA複製後、姉妹染色分体間で起こる限り、エラーのない修復経路であるが、相同染色体間で起こる場合、組み換えの鋳型染色体のDNA配列に変異があると、その変異がホモ化し、いわゆるLoss of Heterozygosity (LOH)を引き起こす(図3)。LOHは多くのヒトがん組織のがん抑制遺伝子が係わる重要な突然変異機構である。このように、HRはDSBの重要な修復機構でありが、時として細胞のがん化に関連するLOH型突然変異も引き起こす。
クロモスリプシスが一度に多数のゲノム再編成を引き起こすに対して、カタエジス(Kataegis)はゲノム内のいくつかの「ホットスポット」に複数の突然変異が発生する現象であり、Mutation Showerとも言われる。カタエジスの原因は不明であるが、APOBECなどの活性化誘導シチジンデアミナーゼの活性変化の関与が示唆されている。カタエジスは、乳がんの全症例のおよそ55%において発生していることから、がんを引き起こす遺伝的不安定化の要因として注目されている(文献9)。
突然変異はゲノム中のどの場所にも起こりうるが、どこに起こるかが重要で、それによって増殖優位性をもち、発がんに寄与するものになるかどうかが決まる。たとえば、DNA修復や細胞増殖、細胞周期チェックポイントに関与するタンパク質の構造を変化させるような変異となることがあれば、タンパク質の構造や機能にほとんど影響しない変異となる場合もある。「ドライバー変異」は、主にがん関連遺伝子に起こる変異で、細胞に増殖優位性を与える。一方、「パッセンジャー変異」は増殖優位性を与えない変異である。ドライバー変異の中にはゲノムの不安定化を導き、突然変異頻度を上昇させ、さらなる突然変異をもたらすものがある。がん抑制遺伝子であるp53は、アポトーシスの誘導、細胞周期チェックポイント、DNA修復に関与し、このp53変異細胞は易変異表現型(Mutator phenotype)を示すことが知られている(文献6)。同様に、MMR遺伝子に変異を持つ細胞も、マイクロサテライトDNAに高頻度に突然変異が観察されるMutator phenotypeを示す。両遺伝子の変異は、多くのヒトがん組織で高頻度に観察される代表的なドライバー変異である。
2.5. 非DNA損傷型遺伝毒性
遺伝毒性試験で陽性を示す物質であっても直接DNAや染色体に作用しないものもある。チューブリンの重合阻害剤であるコルヒチンは細胞分裂装置に影響を与え、染色体の数的異常を引き起こす。また、DNA修復阻害、アポトーシス抑制、細胞周期停止などを引き起こす化学物質も後述する遺伝毒性試験で陽性を示すことがある。これら化学物質のターゲットはDNAではなくタンパク質であり、非DNA損傷性遺伝毒性物質と定義することができる。しかしながら、染色体の数的異常以外、非DNA損傷型遺伝毒性によって突然変異や、ゲノム変化が誘発されるかを見極めることは困難である。いくつかの遺伝毒性試験で陽性を示しても、それが非DNA損傷型であることが証明された場合には、そのリスクは一般に低いと見なされる。
染色体の数的異常は2n の細胞が3n、4n になる倍数性異常(Polyploidy)と、特定の染色体数が増加あるいは減少する異数性異常(Aneuploidy)に分類される。両者とも染色体数を計測することにより認識されるが、現実的には異数性異常を染色体数から評価することは極めて難しい。この場合、小核の形成を観察することで異数性異常を調べることができる。これは、異数性染色体は、細胞分裂後、染色体の不分離によって、小核として娘細胞に残るためである。動原体特異的DNAプローブを用いたFISH法により、その小核が異数性由来か、構造異常由来かを区別することが可能である。
染色体の数的異常が疾患の原因であるのか、それとも結果であるのかの議論はいまでも続いている。遺伝病にはモノソミー(ターナー症候群)やトリソミー(ダウン症候群)などの染色体の異数性を示す疾患が多く存在するが、それら疾患が、外的要因によって誘発されたという証拠は無い。また、がん組織においても異数性、倍数性を示す細胞は多く観察されるが、ほとんどの場合非クローン性の変化で有り、細胞のがん化過程に伴う「パッセンジャー変異」と考えられている。しかしながら、最近、数的異常として生成した小核が、細胞分裂後に一方の娘細胞中にバラバラになって核内に戻り、これが引き金となってクロモプリシスを誘発し、様々なゲノム変異を一気に引き起こすことが報告された(文献10)。ここでの小核が、外的因子によって誘発されるものと同様かは不明であるが、一過性の染色体の異数性が、突然変異やゲノム変化をもたらす新たなメカニズムを示すものである。
3. 遺伝毒性試験
化学物質の遺伝毒性を検出するために、様々なモデル生物を用いた遺伝毒性試験法が開発されている。現在、OECDでは化学物質のヒト健康影響を評価するための毒性試験に関して60以上の試験法がガイドライン化されているが、そのうち13の試験法が遺伝毒性に関するものである。2013年に、あまり活用されなくなったとの理由で6つのガイドラインから削除されたが、以前として遺伝毒性試験はOECDガイドライン試験の中核を占める(表1)(文献11)。遺伝毒性試験法は、細菌や哺乳類培養細胞などを用いるin vitro 試験と、マウス、ラットなどの個体を用いる in vivo 試験に分類できる(文献12,13)。これら試験は主に体細胞を介する遺伝毒性発がん性のスクリーニング試験として利用されることが多いが、後者の in vivo 試験では、ターゲットとして精子や精巣を用いることにより、生殖細胞を介した遺伝性疾患誘発性のスクリーニングとして用いられている。しかしながら、現実的にはヒトの遺伝病が、外来性の化学物質で誘発された事例は報告されておらず、遺伝毒性試験の主たる目的はもっぱら体細胞での発がん性のスクリーニングである。
In vitro試験は、一般に簡便、低コストであり、また、結果も比較的短時間で得ることができる。In vitro試験に用いられる細菌やほ乳類培養細胞は、一般にシトクロムP450(CYP)を代表とする薬物代謝酵素活性を欠いているため、ベンゾ[a]ピレンやアフラトキシン等の代謝物が遺伝毒性を示す化学物質に対しては有効では無い。このため、代謝物を含めてその化学物質の遺伝毒性を検索する場合には、肝臓ホモジネートの9000× g 上清(S9) を添加して試験を行う(文献14)。S9 は、薬物代謝酵素誘導剤(フェノバルビタールと5,6─ベンゾフラボンの併用など)で処理したラットから調製する場合が多いが、目的に応じて他のげっ歯類やヒト由来のS9 を用いて試験を行う場合もある。S9 にはNADPH などの電子伝達系にかかわる補助因子を添加して用いる(S9 と補助因子の混合液をS9 mix と呼ぶ)。S9 mix を添加する代わりに、クローニングした複数のヒトCYP 遺伝子を導入した微生物株や哺乳類培養細胞が樹立され、in vitro 遺伝毒性試験に利用されている。また薬物代謝酵素活性を残している初代肝細胞をin vitro 試験に用いる場合もある。
In vivo試験は、化学物質の代謝、吸収、排泄、分布などを反映した結果を得ることができるため、in vitro 試験の結果よりもヒトへのリスク評価を行う際の外挿性が高い。全身曝露を考慮して、骨髄、末梢血を対象組織として試験を行うのが一般的であるが、特定の臓器や組織での発がん性が疑われる場合、化学物質の用途により(化粧品等)他の組織での試験が望ましい場合、骨髄や末梢血では十分な曝露が期待できない場合などはその限りではない。
個々の遺伝毒性試験は、その生物種とエンドポイントの検出に最適にデザインされており、特定の試験だけですべての遺伝毒性を検出できるわけではない。遺伝毒性試験では通常、相補的な種々の遺伝毒性試験を組み合わせることにより、化学物質が持つ広範な潜在的遺伝毒性を検出することが要求される。2012年の医薬品規制調和国際会議(ICH)において「医薬品の遺伝毒性試験及び解釈に関するガイダンス;S2(R1)」が制定されたが、ここでは、遺伝毒性試験の標準的組み合わせとして、2つもオプションが示されている(文献15)。第一のオプションは、(1)エームス試験(in vitro 試験)、(2) ほ乳類細胞を用いた染色体異常試験、小核試験、もしくはマウスリンフォーマ試験(in vitro 試験)、(3) げっ歯類を用いる造血組織での小核試験あるいは染色体異常試験(in vivo試験)。第二のオプションは(2)のほ乳類細胞を用いたin vitro 試験を必要としない組み合わせ試験であり、その代償として2つの in vivo 試験が求められる。この場合、(1)げっ歯類を用いる造血組織での小核試験あるいは染色体異常試験と、(3) 肝臓でのトランスジェニック遺伝子突然変異試験、もしくはコメット試験が推奨される。
3.1. In vitro 試験
3.1.1. 細菌を用いる復帰突然変異試験(エームス試験)
細菌のDNAの構造や機能、あるいは突然変異誘発機構は、基本的には高等動物と共通すると考えられている。細菌を用いる変異原性試験法の利点としては、DNAの損傷や修復機構の研究が進んでいることから変異原性検出のための様々な変異菌株が充実していること、試験法は高等生物に比べて操作が簡単で、短時間に多くの検体を試験でき、経費が安価であること、また、すでに多くの試験がなされ、データベースが充実していること、などが挙げられる。最も汎用されている試験法は復帰突然変異試験(エームス試験)である。ネズミチフス菌(サルモネラ菌)と大腸菌のアミノ酸要求性株を用いて、その復帰突然変異を指標として変異原を検出する方法である。ブルース・エームス博士によってサルモネラ菌を用いる試験法が開発されたことから、大腸菌を用いる方法も含めて広義にエームス試験と呼ばれている(文献16-18)。試験用サルモネラ菌株はいずれもヒスチジン生合成に関与する酵素遺伝子(たとえばhisG、hisD)に変異があり、ヒスチジンを含まない培地上では生育できない(ヒスチジン要求性)。しかし化学物質の作用によって当該遺伝子に変異が起こるとヒスチジンを合成できるようになる(ヒスチジン非要求性)ため、ヒスチジンを含まない培地上でコロニーを形成できるようになる。試験菌株の表現型がヒスチジン要求性から非要求性に復帰するため、復帰変異試験と呼ばれる。復帰変異は、元の変異部位が再度変異することによって元に戻る場合もあるが、変異部位の周辺、あるいはtRNA 遺伝子に変異が起きて表現型が復帰するため、比較的多様な変異を検出することができる。エームス試験に用いるサルモネラ株としては、塩基置換変異を検出するTA1535、TA100、TA102、フレームシフト変異を検出するTA1538、TA98、TA1537、TA97 などがある(表2)。これら試験菌株は、いずれも細胞壁のリポ多糖類の生合成能を欠くので化学物質などの細胞内への透過性が高く、またまたTA102 株を除く株では、ヌクレオチド除去修復に関与するuvrB遺伝子の欠失により、変異原への感度が高められている。さらに、DNA 損傷を効率よく突然変異に転換させるために、TA97、TA98、TA100、TA102 にはpKM101 プラスミドが導入されている。
大腸菌の場合は、トリプトファン要求性変異体WP2uvrAまたはWP2uvrA/pKM101を用いる(表2)。試験の原理および方法は、アミノ酸要求性がサルモネラ菌の場合のヒスチジンがトリプトファンに代わるだけで、サルモネラ菌の場合と同様である。塩基対置換型の変異原に高感受性で、またuvrA遺伝子が欠損した紫外線感受性株である。
エームス試験では異なった特性を持つサルモネラ菌および大腸菌を組み合わせて用いることにより、変異原を幅広くスクリーニングすることができる。また、エームス試験の背景データの変異頻度は比較的低く、かつ安定しており、背景データの変異頻度から通常検出される最大変異頻度までの広範なダイナミックレンジの試験検体の曝露が可能である。この広いダイナミックレンジと安定した背景データのため、誘発する反応が弱い化学物質でも高感度かつ信頼性の高い検出が可能となる。
エームス試験のOECD試験ガイドライン(TG471)ではエームス試験結果の評価および解釈において、陽性結果であると決定する基準をいくつか示している。例えば、濃度依存的、および再現性のある増加とそれを裏付ける生物学的関連性や統計解析である。しかしながら、多くの場合、経験的に陰性対照からの2倍、もしくは3倍以上の増加をもって陽性としている場合が多い。生物学的関連性や科学的判定を無視したこれら判定法には偽陰性、もしくは偽陽性が含まれることが多く、注意を要する。
3.1.2. 哺乳類細胞を用いた遺伝子突然変異試験
哺乳類培養細胞を用いる遺伝子突然変異試験には、主に内因性の薬剤耐性遺伝マーカー(HPRT、TK 遺伝子)を用いた劣性型突然変異を指標として用いる。エームス試験が復帰突然変異試験であるのに対して、これら遺伝子の変異は遺伝子をコードするタンパク質の消失、もしくは不活化をもたらす様々なタイプの変異検出することができるため前進突然変異試験とも呼ばれる。X染色体上に位置するHPRT遺伝子はプリン塩基のサルベージ回路に関与するヒポキサンチン・ホスホリボシル転移酵素をコードしており、この酵素活性を失った細胞は、DNA合成を阻害する核酸代謝毒である6-チオグアニン(6-TG)に対して耐性となる。細胞を化学物質で処理後、6-TGを含む培地で細胞を培養し、突然変異によって耐性となった細胞コロニーの出現数からその化学物質の変異原性を評価することができる。本試験は、活性型X染色体を1本持つ2倍体細胞であれば、樹立された細胞株だけで無く、ヒトリンパ球などの初代培養細胞も用いることができる。汎用される細胞株としては、チャイニーズハムスター細胞株CHO、CHLおよびV79などが挙げられる。本試験で検出される突然変異は、主にHPRT遺伝子内の点突然変異や比較的小さな欠失や挿入、ならびに3Mb以下のHPRT遺伝子全体を含む欠失である。染色体レベルの大きなX染色体上の欠失は、HPRT遺伝子近傍に存在する細胞の生存に重要な遺伝子(Essential gene; EG)の欠失をも伴うため、致死性となり検出できない(図3)。
TK 遺伝子はチミジンキナーゼをコードし、この酵素が欠損すると細胞はトリフルオロチミジンに対して耐性となるため、HPRT遺伝子と同様に遺伝子突然変異試験のマーカーとして用いることができる。TK 遺伝子は常染色体上に存在しており(ヒトは17番染色体、マウスは11番染色体)、劣性型突然変異を検出するためにはTK 遺伝子はヘテロ(TK+/-)である必要がある。そのため特定の細胞でしかこの試験は利用できない。マウスリンパ腫細胞株L5178Y、ヒトリンパ芽球細胞株TK6は、化学物質での変異により予め、TK 遺伝子の片側のアリルに点突然変異が導入されているため、TK 遺伝子突然変異試験に用いることができる。特にL5178Yを用いた試験系はマウスリンフォーマ試験(MLA)と言われる。TK 遺伝子突然変異試験の最大の特徴は、TK 遺伝子内の比較的小さな欠失や挿入だけでなく、染色体レベルの大きな欠失や、相同染色体間の組み換え変異をも検出できることである。後者の変異は、ヒトの腫瘍形成において一般的に認められるがん抑制遺伝子の遺伝子変化であるヘテロ接合性の消失(LOH)と同様であり、がん発生機構のモデルとしても、試験系の意義は高い(図3)。このようにTK 遺伝子突然変異試験は、点突然変異から染色体レベルの大きな遺伝子変化まで検出できる広範囲の突然変異スペクトルをもつ。さらに、TK 突然変異体には増殖性の異なる2つの変異体細胞が存在し、増殖が遅い変異体は染色体レベルの大きな遺伝子変化をと伴うことから、化学物質で誘発された変異体細胞を分類することにより、その化学物質が点突然変異を誘発する変異原性物質(Mutagen)か、染色体異常を誘発するClastogenかを同定することができる。
TK6を用いたTK 遺伝子突然変異試験とMLAは2015年にOECD遺伝毒性試験ガイドラインTG490として新たに収載された(文献19)。また、MLAについては染色体レベルの大きな遺伝子変化まで検出できるため、染色体異常試験の代替として利用できることが、医薬品の安全性試験ガイドラインで認められている。しかしながら、MLAに用いられるL5178Y細胞はp53遺伝子変異細胞であり、アポトーシスの異常、細胞周期チェックポイント機構の異常から遺伝的に不安定で、偽陽性率が高い。遺伝子突然変異試験としてはTK6の方が優れていると考えられる(文献20)。
3.1.3. 哺乳類細胞を用いた染色体異常試験
染色体異常試験は、ほ乳類の培養細胞を被験物質で処理した後、一定時間後に分裂中期の細胞の染色体標本を作製して、光学顕微鏡により染色体の構造異常および数(倍数体)的異常を検索する試験である。ここで観察される染色体異常は、遺伝病やがん組織で観察される安定型の染色体異常と異なり、一過性で、染色体異常を持つ細胞の多くは死滅すると考えられている。そのため、厳密には変異原性を評価している訳ではない。しかしながら、哺乳類細胞を用いた染色体異常試験は、染色体構造を持たない細菌と違った複雑な機能を営むほ乳類細胞に対して、化学物質の及ぼす直接的な遺伝的影響をとらえることができる点で、欠かすことのできない方法として評価され、各種試験法のガイドラインに取り入れられている(文献24)。使用する細胞は、染色体が大きくかつその数が少なく、比較的安定な核型を示すチャイニーズハムスターの株細胞(CHO、CHL、V79)が、扱いやすさ、解析の容易さの点から汎用されている。また、初代ヒトリンパ球細胞や、ヒトリンパ芽球細胞株TK6なども用いられる。
染色体の異常は、数の異常と、構造の異常に分けられる。構造異常には二つの基本型がある。一つは染色体型(Chromosome-type)といわれるもので、染色体の両方の、染色分体上の同一部位に関与する異常である。もう一つは染色分体型(Chromatid-type)といわれるもので、染色体の一方の染色分体のみに関与する異常である。これらの異常はさらに二つのタイプに分類できる。一つは単純な切断(Break)であり、もう一つは、2カ所以上の切断部位での相互変換により生ずる交換(Exchange)型異常である。交換型異常には多種多様なものが含まれているが、基本的な分類は染色体型、染色分体型ともに同じである。染色体の構造異常を引き起こす物質をClastogenと呼ぶ。数的異常には異数性(Aneuploidy)と倍数性(Polyploidy)とがある。前者は染色体の数が1~数本増加または減少するもので、その結果、高二倍性(Hyperdiploidy)や低二倍性(Hypodiploidy)細胞が生じる。一方、倍数性は染色体数が倍化する現象で、これによって三倍性(Triploidy)や四倍性(Tetraploidy)細胞などが形成される。これらは分裂機構に対する傷害作用や細胞融合の結果として生ずるもので、前者には細胞質分裂の阻害、紡錘糸の機能障害による細胞分裂阻害、一部染色体の不分離(Non-disjunction)による不均等分裂、分裂期あるいはG2期への移行阻害など種々の要因が含まれる。
3.1.4. 哺乳類細胞を用いた小核試験
分裂中期の染色体解析は手間がかかり、また染色体の観察には熟練を要するため、簡単な細胞遺伝学的手法として小核試験の重要性が高まっている。小核は、染色体の断片または丸ごとの染色体を含む主核と離れて存在する主核と同様に染色されたクロマチン構造をもつ小体である。これは、染色体の構造異常、あるいは数の異常を誘発する染色体の分裂装置の異常により生成された紡錘糸が結合していない染色体断片または染色体が、細胞分裂の際に両極に移動できず主核に取り込まれず取り残されるために生成する。したがって、小核が生成されたということは染色体の構造異常、あるいは数の異常が起こった証拠である。In vitro小核試験は、細胞に被験物質を作用させ、一定時間後に間期細胞のスライド標本を作製して細胞質内に小核を有する細胞を観察する染色体異常誘発性を検出する。この試験は染色体異常試験と同等の試験とされているが、先の述べた簡便さと共に、丸ごとの染色体を含む小核も検出できることから、異数性誘発物質(Aneugen)の検出にも利用されている(文献22,23)。構造異常と異数性を区別するためには、染色体の動原体のDNA 配列に対する特異的DNAプローブをもちいたFISH 法(Fluorescence In Situ Hybridization) により、小核中の動原体の有無を判定し、その小核が構造異常に由来する染色体断片なのか、異数性による丸ごとの染色体であるかを調べることができる(文献24)。
使用する細胞は、ほ乳類培養細胞を用いる染色体異常試験で使用できる細胞であれば使用できる。また、染色体数が多く染色体の観察が難しい細胞への利用も容易である。小核が生成するには、細胞分裂が必要である。そのため、アクチン重合阻害剤のサイトカラシンB(cytoB)を使用し分裂細胞を識別する方法が開発されている。cytoB存在下で細胞分裂した細胞は、核は二つに分かれるため、この二核の細胞を観察対象とすれば分裂細胞のみでの小核観察が可能である。ただし、株化細胞のように高い細胞分裂により増殖が早い細胞の場合にはcytoB使用は不要である。
3.2. In vivo試験
3.2.1. 小核試験
哺乳類赤血球小核試験は、動物の骨髄または末梢血中の幼若赤血球(多染性赤血球)を観察し、小核をもった細胞の比率を測定することで化学物質のin vivoでの染色体異常誘発性を検索する方法である。通常はげっ歯類が用いられるが、その他の動物種(イヌ、霊長類、ヒト)についても研究が行われている。骨髄赤芽球が幼若赤血球(多染性赤血球または網状赤血球とも呼ばれる)に分化し、末梢血中に移動する際、主核は脱核し、通常無核細胞となる。その後、この間に形成されていた小核は細胞質内に留まる可能性がある。これらの細胞には主核がないため、小核の視認化や検出は容易である。小核は、無動原体染色体、遅延染色体断片、または染色体全体から生じることあるため、本試験は、染色体異常誘発物質と異数性誘発物質の両方について検出能がある。動物への被験物質の投与は、ヒトの曝露経路を基本とするため通常、経口投与が用いられる。骨髄を用いた小核試験では、一般的に、1日1回、2日間投与後、18~24時間の間に標本作製を行、小核を観察する(文献24)。
In vitro 小核試験と同様にFISH 法を用いることにより、染色体異常誘発物質(動原体のない小核を形成)と異数性誘発物質(動原体のある小核を形成)を識別することができる。小核試験が陽性の場合は、当該物質がin vivo において遺伝毒性を有する高いエビデンスとなる。ただし、小核形成は低体温、造血機能の更新などDNA 損傷とは無関係の要因によっても誘発されるので、結果の解釈には注意を要する。小核試験が陰性の場合は、in vivoにおいて遺伝毒性を発現しない可能性を示唆するが、その際には骨髄が試験化合物に十分暴露されていることをトキシコキネティクス、あるいは幼若赤血球の割合低下で証明することが重要である。
赤血球小核試験の場合、観察対象が単純であることもあり、フローサイトメーターや、レーザースキャニングサイトメーター等を用いた観察の機械化が進んでいる(文献25,26)。赤血球以外の他の臓器を標的とした小核試験法の開発が精力的に行われ、現在では肝臓、消化器系臓器をはじめとし、多くの組織を標的とすることが出来るようになってきた(文献27)。
3.2.2. トランスジェニック動物を用いる遺伝子突然変異(TGR)試験
本試験で用いられるのは主としてMutaTMMouse、BigBlueⓇ、gpt deltaと呼ばれるトランスジェニックマウスおよびラットである(文献28,29)。これらのゲノムには、λファージDNAをベクターとして、突然変異を検出するためのレポーター遺伝子が多コピー導入されている。レポーター遺伝子はλファージまたはバクテリア由来であり、動物個体内では発現せず遺伝子機能による選択圧を受けないため、遺伝的に中立であると言える。通常の試験では、動物個体を化学物質に曝露させたのち、各種の臓器(たとえば肝臓、胃、大腸、骨髄等)からDNA を抽出しin vitro パッケージング法によってファージ粒子を回収する。回収したλファージを宿主大腸菌に導入することで、動物の体内(in vivo)で起きた変異を大腸菌の変異体として検出することができる。この試験の最大の利点は、生殖細胞を含むすべての臓器で突然変異を観察できる点であり、発がんの標的臓器において変異を観察し、当該物質が遺伝毒性を介してがんを誘発したか否かについて知見を得ることができることである。
動物への投与経路は、強制経口投与が一般的だが、他の方法を選択することも可能である。突然変異は投与ごとに蓄積することから、十分な突然変異誘発能を検出するためには反復投与が必要とされており、通常の組織では1日1回28日間の反復投与と最終投与後3日目の試料採取が推奨されている。また、動物愛護の立場から、試験に用いる動物数を削減する目的で、一般毒性試験への組み入れ(Integration)、または小核試験などの他の遺伝毒性試験との組み合わせ(Combination)も推奨されている。
3.2.3. コメット試験
コメット試験(単細胞ゲル電気泳動法とも呼ばれる)は、化学物質によるDNAの初期損傷を検出する試験法である(文献30,31)。コメット試験には、中性とアルカリ性の2つの試験法がある。中性コメット法はDNAの二本鎖切断の検出に有効で有り、アルカリコメット法は二本鎖切断に加えて、一本鎖切断、AP部位(脱塩基部位)やアルカリ感受性部位を有するDNA損傷の検出も可能である。遺伝毒性試験としてはアルカリコメット法が主流である。細胞が採取、単離できればどの臓器(器官)でも実施可能である。投与回数や投与経路は小核試験と同様で構わないが、初期損傷の検出系であることから、化合物によって受けた損傷が修復される前に標本作製することが求められる。一般的には、被検物質を2回あるいは3回投与し、最終投与後2~6時間で標本作製することが推奨されている。
臓器の一部から単離した細胞の懸濁液と低融点アガロース液を緩やかに混和し、スライドグラス上に塗布し、コメット試験の標本を作製する。その後、界面活性剤と高濃度の塩を含むアルカリ溶液に浸し、細胞膜や核膜などを融解させ、標本を高アルカリ条件下(>pH 13)で電気泳動する。泳動緩衝液が高アルカリであることにより、アンワインディング(DNAの巻き戻しや二本鎖が一本鎖へとなる)され、一本鎖切断されたDNAも電気泳動され検出可能となる。電気泳動は、分子量によって移動距離が異なるため、損傷を受け、低分子量化したDNA断片は、その程度に応じて核から尾を引いた彗星(コメット)のような像を呈する。コメット試験の評価には、DNA損傷性を定量的に評価するために、画像解析装置を用いて解析し、全体のDNAに対する尾のDNA量の割合(% tail DNA)や尾の長さ(Tail length)などが指標として用いられる。コメット試験一般に高感度の試験とされているが、大きなDNA付加体等の検出は困難で有り、また、アポトーシスにより二次的なDNA損傷が起こりしばしば偽陽性結果をもたらすことがあるので、その評価は慎重にすべきである。
3.2.4. Pig-a 試験
Pig-a(Phosphatidylinositol glycan anchor biosynthesis class A) 試験は、近年開発された赤血球を対象としたin vivo遺伝子突然変異であり、現在OECD試験ガイドライン化のためのバリデーション研究が進行中である(文献32)。 Pig-a遺伝子はX染色体上に位置し、その遺伝子産物は、赤血球の膜タンパクであるGPIアンカー生合成の第一段階に関与する。この遺伝子に突然変異が起こると、赤血球はGPIアンカー膜タンパク質を消失する。この原理を利用し、赤血球のGPIアンカー結合タンパク質であるCD24や、CD59に対する蛍光標識抗体で染色し、フローサイトメーターによってこれらのGPIアンカー結合タンパク質が細胞膜表面に提示されている赤血球とされていない赤血球を識別することができる。赤血球全体のうちのこれらの表面マーカータンパク質が提示されていない赤血球を計数することにより、遺伝子突然変異体の頻度を測定することができる。 Pig-a試験は、少量の末梢血とフローサイトメーターを用いて遺伝子突然変異の解析が可能な手法であり、トランスジェニック動物を用いた遺伝子突然変異試験と比較して、短時間で効率的にin vivoでの遺伝子突然変異の評価が可能である。また、解析に必要な血液サンプルは、動物の尾静脈より少量採血するだけで十分であり、実験動物を解剖する必要がないため、経時的に遺伝子突然変異の推移をモニタリングすることができる。また、他の毒性試験と組み合わせて行うことができるため、動物実験の削減にも有効である。
3.3. 生殖細胞試験
生殖細胞試験としては、げっ歯類を用いる優性致死試験、マウス転座試験、哺乳類の精原細胞を用いる染色体異常試験がある。
げっ歯類を用いる優性致死試験では、曝露を受けた親動物(通常、ラットまたはマウスの雄)の生殖細胞に生じた優性致死突然変異によって、胚または胎児死を生ずるような遺伝毒性物質を検出する。一般に、優性致死は染色体の構造異常または数的異常に起因するが、遺伝子突然変異や他の毒性作用も関連する。マウス転座試験は、曝露を受けた雄マウスの第1世代の個体に生じる染色体の構造変化、主として相互転座を観察する。両試験とも非常に多くの動物を要するため、実施は稀である。従って、現在ではこれら試験を実施できる専門家も少ない。
3.4. In silico 、QSAR手法
近年、IT (Information Technology)の進歩により生物学的試験に頼らず、in silicoにより毒性予測を行う手法が注目を浴びている。 In silico手法は実験動物を必要としない究極の動物代替法である。Quantitative Structure Activity Relationship (QSAR: 定量的構造活性相関)は化学構造と毒性の相関に関する研究であり、構造的に類似した物質の既知の活性に基づき、生物学的毒性試験を実施することなく評価対象物質の毒性を予測することができる。現在、様々な遺伝毒性試験結果の予測に対してQSARが開発されているが、エームス試験結果の予測を目的としたQSARが圧倒的に多い。これは以下の理由による。
- エームス変異原性には閾値がないとされているため暴露量が低くても変異原性の評価、特にその有無は化学物質の発がんリスクを評価する上で重要な決定因子となる。そのため、食品中に微量に含まれる残留農薬、食品添加物、プラスチック容器からの溶出物、また医薬品中の不純物のような極めて低曝露の化学物質に対しても常に変異原性の評価が求められる。これら微量の化学物質は実際の試験が困難であることが多く、QSARによる評価が必要とされる。
- エームス変異原性化学物物質は基本的に電子求引性化学構造を持ち、物理化学的性質から変異原性が科学的に予測可能である。
- エームス試験結果は再現性がよく、他の試験に比べて結果が安定している。また、毒性試験の中で最も試験データ数が多い。これらのことから、試験データを基にQSARによる予測モデルが作りやすい。
- 2014年に医薬品規制調和国際会議(ICH)において、医薬中に含まれる不純物のエームス変異原性評価にQSARの利用がガイドライン(ICH-M7)に明文化された。これは、QSARが実際の生物学的試験の代替として人健康影響評価に用いることが許可された最初のガイドラインである(文献33)。このガイドラインによりQSARはエームス変異原性を予測するためのプレスクリーニングの目的から、実際の化学物質の変異原性を評価するための試験として扱うことになり、エームス変異原性QSARの研究がこの数年の間に大きく発展した。
化学物質の構造から変異原性、発がん性を予測する研究は古くから行われている。1960年代、James & Elizabeth Millerらは発がん性アルキル化剤の求電子性に注目し、多くの発がん性化学物質は、求電子性誘導体か、もしくは生体内でそれらに代謝されて、発がん標的組織においてDNAやタンパク質などの求核性基と結合し、がんを引き起こすという求電子理論を唱えた(文献34)。それ以降、化学発がんに関する研究は急速に進展した。Bruce Amesは発がん性化学物質(アルキル化剤、インターカレーターなど)に感受性をもつ一連のサルモネラ変異株を開発し、いわゆるエームス試験を確立した(文献17)。エームス試験は、発がん性化学物質を検出するin vitro モデルといえる。変異原性機序による発がん物質のほとんどはエームス試験で陽性を示し、Millers仮説の範疇で妥当と考えられた。Millerの求電子理論に続いて、John AshbyとRay Tennantは発がん化学物質に対する構造アラート(Structural Alert; SA)と、発がん性予測のコンパイルを開発した。発がん性に対するSAは、化学物質の発がん性活性に関連した分子官能基、または部分構造と定義され、同時に発がんの主要なステップであるDNAへの損傷や、突然変異の誘発をもたらす変異原性のSAとも考えられた(文献35)。Ashbyは米国National Toxicology Programの222の化学物質の中からげっ歯類発がん性試験陽性と強い相関性を示す18種類のSAを同定した(図5)。現在、エームス変異原性QSARモデルはルールベースと、統計ベースの2つのモデルが主であるが(図6)、ルールベースQSARはAshbyらが行ったように、既知データから陽性をもたらす特徴的な部分構造を定義し、ルール化された経験則から、定性的にエームス試験結果の予測を行うものである。一方、統計ベースQSARは、化学物質の構造をフラグメントに分解後、その構造を幾何学的、電子的、物理化学的等の記述子(数値データ)に変換し、エームス試験陽性と相関性の高い記述子を用いて、多変量解析、パターン認識などの機械学習により試験結果を予測する人工知能型モデルである。
これまでエームス変異原性QSARに関しては、学術的目的、商用目的で多くのQSARモデルが開発されてきた。以下に代表的なエームス試験予測QSARモデルを記載する。
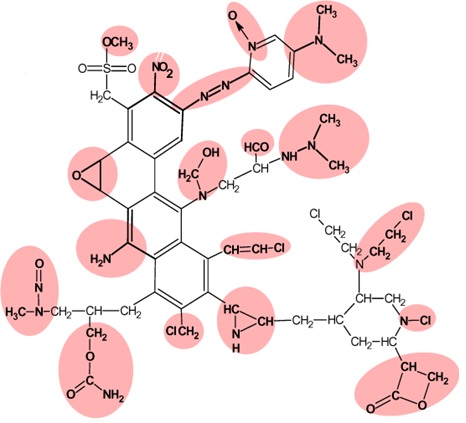
図5.Ashbyらによって提唱された発がん性を有する構造アラート
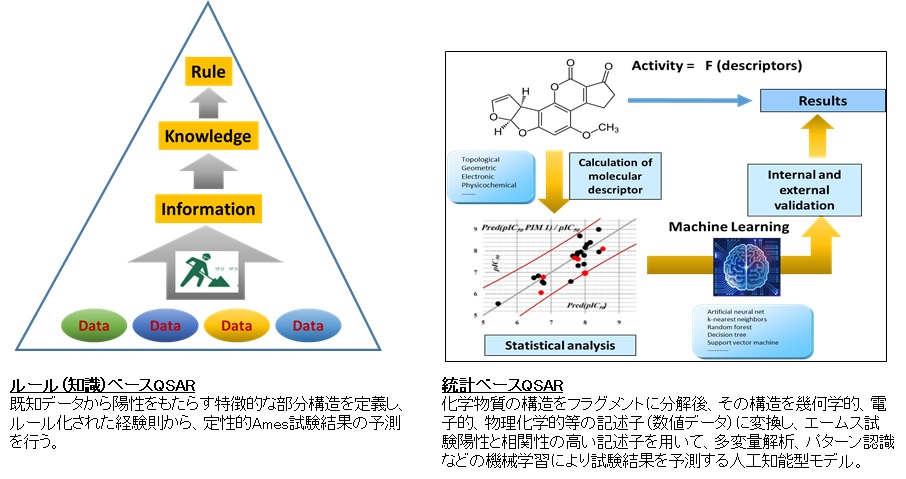
図6.ルール(知識)ベースQSARと統計ベースQSAR
3.4.1. Derek Nexus(Lhasa Limited, UK):ルールベースQSAR
Derek(Deductive estimation of risk from existing knowledge)NexusはLhasa Knowledge Suiteの一部として市販されているルールベースのエキスパートQSARシステムである。ここに含まれる知識ルールは、構造アラート、化合物例および代謝活性化とメカニズムに関する知見を考慮して作られている。これら知識ルールは、民間企業、大学、公的研究機関、および非営利団体によるデータや知識の提供により継続的開発されている。Derek Nexusは、その知識ベースに構造パターンとしてコード化されたToxicophore(すなわち、毒性作用に関与すると想定される構造アラート)を有する標的化合物の構造特性を比較することによって予測を導き出す。最終的な予測は、クエリー構造中のToxicophoreの存在、ならびに分子特性を考慮に入れる推論スキームから導かれる。Derek Nexusによる予測は通常、関連する文献を参照することにより妥当性が確認され、ユーザーはより信頼性の高い予測を得られる。Derek Nexusの主な長所は、予測の透明性、ルール開発にユーザーグループによる評価を受けている点、および新規ルールの追加が容易な点である。また本システムがルールベースのシステムであるため、規定されたトレーニングセットや適用範囲はない。しかし、最近実装された構造分類機能により、ユーザーが陰性予測を実証することが可能となった。推論レベルが曖昧またはそれ以上のアラートを持つすべての化合物は、本システムにおいて陽性予測として処理されている。
3.4.2. CASE Ultra (MultiCASE Inc., USA):統計ベースQSAR
CASE Ultraは、米国のMultiCASE Inc。が開発した統計ベースのQSARに基づく毒性予測ソフトウェアである。本ソフトウェアは、構造アラート(毒性の原因と考えられる部分的化学構造)の有無に基づいて毒性を予測する。本ソフトウェアの統計的手法をベースとした部分のために、機械学習技術を用いてトレーニングデータから自動的にアラートが抽出される。トレーニングに必要な入力データは化学構造とその毒性ラベルのみである。クエリー化学物質について予測される毒性の程度は、特定されたアラートおよびアラート周囲の構造的環境に依存する。アラート周囲の構造的特徴は「モジュレーター」と呼ばれ、これらもトレーニングデータから自動的に学習される。このアルゴリズムでは、連続した毒性エンドポイントのQSARモデルを構築するために、様々な物理化学的パラメータおよび記述子が使用されている。エームス変異原性に関するCASE Ultraの主なモデルは、GT1_AT_ECOLI、GT1_A7B、PHARM_ECOLIおよびPHARM_SALMの4つのモジュールで構成されているが、2018年からの新バージョンではSalmonella/E。 ColiコンセンサスモデルであるGT1_BMUTが、2019年にはPharm_BMUTの新モジュールがリリースされた。
3.4.3. Leadscope Model Applier; LSMA(Leadscope Inc., USA):統計ベースQSAR
LSMAの統計的変異原性QSARモデルは、米国食品医薬品庁と共同で開発された統計ベースのQSARツールである。これらのモデルは、過去に公表されたエームス変異原性データのトレーニングセットから構築され、構造記述子は、(1)事前に定義された構造的特徴、(2)自動的に生成される化学骨格、(3)外部知識、(4)算出された特性に基づいている。選択した記述子(独立変数)およびエームス変異原性データ(応答変数)を用いて部分ロジスティック回帰モデルによりエームス試験結果を予測する。モデルからは、陽性の結果が得られる確率、活性化および不活性化に寄与する構造的特徴、ならびにトレーニングセットの化学物質に関する詳細な試験情報等を提示してくれるため、専門家の詳細なレビューが可能である。
3.4.4. TIMES_AMES(Bourgas University, Bulgaria):ルールベースQSAR
TIMES_AMES QSARツールはブルガス大学が販売提供するOASIS/TIMESソフトウェアに組み込まれている。Ames/QSARツールには、構造アラート、それ以外の分子構造の影響を説明するための修飾因子とともに、DNAと構造アラートとの相互作用メカニズムが含まれている。構造アラートの決定にはルールベースが利用され、変異原性の予測にはパターン認識法(Mechanism-based common reactivity pattern; COREPA))が使用されている。OASIS/TIMESは、代謝経路に基づく肝代謝シミュレーターを備えている(Tissue Metabolite Simulator; TIMES)。このモデルで使用したトレーニングセットの化学物質は、代謝活性化なしで変異原性を持つもの、代謝活性化後に変異原性を持つもの、および代謝活性化の有無を問わず変異原性が無いものに分類される。クエリー化合物をラットS9存在下でのエームス変異原性を予測すると、化合物の代謝マップとともに、変異原性を持つと予測される代謝物を表示してくれる。これがOASIS/TIMESの最大の利点である。
4. 遺伝毒性試験と発がんリスク評価
4.1. 遺伝毒性試験結果の評価および解釈
ほ乳類細胞を用いたin vitro 試験系では、げっ歯類のがん原性予測に対してしばしば偽陽性の結果を与えることがある(文献36)。偽陽性の原因については不明であることも多いが、強い細胞毒性、高浸透圧、沈殿の生成、非生理的pHなどは非特異的な影響により陽性反応を示すこともあるので注意を要する(文献37)。このような偽陽性を防ぐため、試験実施の最高濃度、細胞毒性レベルに関してはガイドラインで規定されている。また、極めて弱い陽性反応に関しては統計学的解析だけでなく、経験的手法によって陽性、陰性が決定されるが、これらの中には擬陽性が多く含まれると考えられる。最終的な判定が困難である場合はInconclusive、もしくはEquivocalとする場合がある。
一方、エームス試験ではバクテリア特異的Nitroreductaseにより哺乳類細胞には外挿できない陽性反応(偽陽性)を示すことがあるので注意を要する(文献38)。また、エームス試験を含むin vitro 試験で使用されるS9にはAcetyltransferaseやSulfotransferase等のphase II酵素が存在しないため、これら酵素を介して活性化される変異原物質は陰性と判定される(偽陰性)こともある(文献39)。このような変異原物質の評価には薬物代謝の知識が不可欠である。
エームス試験の結果は比較的擬陽性が少なく、陰性、陽性と明確に判断されることが多い。しかしながら、これはエームス試験陽性の定義として、少なくとも1つの菌株で、S9存在下、もしくは非存在下で、陰性対照の2倍を超えた場合を陽性とするというガイドラインによるためである(2倍ルール)。従って、1.9倍の増加は陰性であるが、2.1倍の増加は陽性とする杓子定規なルールによって陽性、陰性が区別されている。2倍ルールはOECDガイドラインには記載は無いが、世界中の多くのエームス試験結果の判定で利用されている(菌株によっては3倍ルールが採用されている場合もある)。全ての化学物質がエームス試験によって明確に変異原性物質と非変異原性物質に分類されることは、後述するが変異原性には閾値が無いことを考慮すると、科学的に考えても奇妙なことで有り、境界領域の反応性を示す物質は間違って、陰性、陽性と判定されているものもある。このような場合には先に述べたQSARを利用することが推奨される。QSARの結果は変異原性の原因となる構造アラートを示してくれる場合がある。2倍以下の弱い反応性であっても、再現性、用量依存性が有り、さらにQSARで変異原性が示唆された場合には陽性と判定することが科学的に正しい。
陽性のin vitro データは、化学物質の特性として遺伝毒性を持つことを示しているが、多くの場合、これらin vitro の陽性結果の生物学的意義は、適切なフォローアップ試験で検証される必要がある。ほ乳類細胞を用いたin vitro 試験での陽性に対しては、ケースバイケースで適切なin vivo試験が選択されるが、一般的には同じエンドポイントのin vivo試験が選択される。また、先の医薬品のガイダンスのように、既に造血組織での小核試験を実施している場合には、異なる組織での試験が推奨される。一般には肝臓でのコメット試験、TGR試験が推奨される。一方、エームス試験で陽性を示した場合のin vivoフォローアップ試験はTGR試験が必須であるが、エームス試験陽性の程度と代謝活性化の有無、他のin vitro 試験結果、構造アラートの有無等を考慮すれば、他のin vivo試験でのフォローアップも可能な場合もあるかもしれない。
フォローアップ試験ができない場合、もしくはフォローアップ試験でも陽性反応を示し、遺伝毒性、もしくは変異原性物質と評価された場合には、その化学物質の発がん性について適切にリスク評価をすることが重要である。
4.2. 遺伝毒性(変異原性)と閾値
遺伝毒性試験は一般的に、遺伝毒性や変異原性の有無を検出する定性的試験法であり、その結果は「陽性」もしくは「陰性」として判定される。したがって遺伝毒性試験では、このような定性的結果が健康リスク評価に利用される。一方、多くの化学物質の毒性は健康リスクを評価する場合、理論的、実証的研究から、これ以下であれば健康影響がみられないレベル、すなわち閾値がある用量反応モデルが用いられる。これにより一日摂取許容量(Acceptable Daily Intake; ADI)を定めることができる。しかしながら、その化学物質の発がん性が問題となり、さらに遺伝毒性が認められるとやっかいである。他の毒性と異なり遺伝毒性には閾値がないとされているため、摂取量をゼロにしない限り、健康リスクもゼロにならないとの論理からADIを設定することができない。ここに遺伝毒性発がん物質のリスク評価の特異性がある。
遺伝毒性の閾値存在の証明として、動物に投与する遺伝毒性物質の用量を段階的に下げて、無毒性量が存在するかどうかを、様々な遺伝毒性のエンドポイントで検出する方法が試みられている。ホッケースッテック様の用量相関性を示した場合、閾値と見なすとする論理であるが、これには無理がある。先に述べたが、遺伝毒性とはメカニズムで有り、毒性症状ではない。用量を段階的に下げて、遺伝毒性の無作用量が存在するかどうかを見るというストラテジーは、遺伝毒性試験の検出感度を見るに過ぎない。そもそもいかなる生物試験も低用量域ではホッケースッテック様のカーブを取るのは当然である(図7)。仮にある化学物質が一般毒性試験で、肝障害のエンドポイントでホッケースッテック様のカーブを示さず、無毒性用量が設定できない場合、その物質の肝障害には閾値が無いと考える人は誰もいない。遺伝毒性の閾値は実験的に証明できるものでは無い。遺伝毒性と遺伝毒性発がん性に閾値が設定できないのは最初の述べたその遺伝毒性発がんメカニズムの論理によるものである。
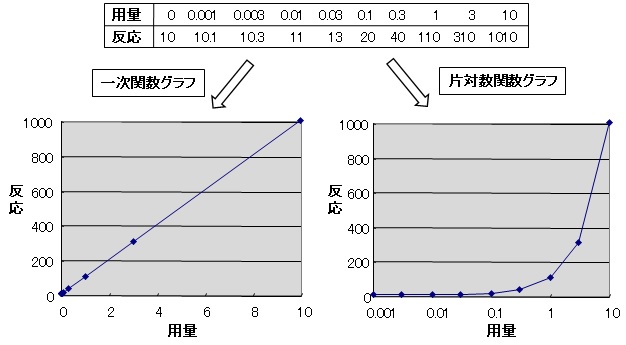
図7.閾値無し用量相関モデルのグラフ表示
冒頭で述べたように遺伝毒性は発がん性の重要なメカニズム有り、遺伝毒性試験結果に閾値が存在するか否かの議論は意味がない。遺伝毒性発がん物質と非遺伝毒性発がん性物質の発がん性の閾値の有無を議論の対象とすべきである。メカニズムの観点から閾値を考えると、非DNA遺伝毒性発がん物質には閾値が設定できると考えられる。これは、遺伝毒性物質のターゲットはDNAであるのに対して、非遺伝毒性発がん物質のターゲットはタンパク質であるためである。ターゲットとなるタンパク質分子は細胞中に数多く存在する。非遺伝毒性発がん物質が高濃度であればそれらタンパク質分子の多くに影響を与え、細胞レベルで遺伝毒性影響をもたらしかもしれないが、極低濃度であれば影響はないことは容易に想像できる。このようなことから非遺伝毒性発がん物質に関しては理論的に閾値が設定できる。また、いくつかの実験により非遺伝毒性発がん物質の閾値の存在は証明されており、多くの専門家はこの問題に関して異論はない。問題は、DNAに直接作用する遺伝毒性発がん物質の閾値である。遺伝毒性発がん物質は最終的に突然変異をもたらす変異原性発がん物質と、それ以外の非変異原性発がん物質に分類されるが、後者に関しては閾値が設定できると考える。後者は主に、DNA損傷性、染色体異常誘発性、小核誘発性のみを誘発する物質が対象である。これらの変化は一過性で有り、その影響は可逆的、且つ非永続的であるため次世代の細胞に残ることはない。非変異原性遺伝毒性とはDNA損傷と、それに対応する細胞応答であり、細胞のがん化とは直接関係の無いインディケーターもしくはサロゲートマーカーである。これらバイオマーカーには明らかに検出感度が存在するため閾値が設定できると考える。
一方、変異原性発がん物質がもたらす突然変異は遺伝物質(DNA、染色体)の量、あるいは構造の不可逆的かつ永続的な変化である。また、たった一つの突然変異でも、その変異が、がん遺伝子、がん抑制遺伝子などの細胞のがん化に重要な遺伝子に生じた場合にはがん原細胞が生じる。がんはたった一つのがん原細胞に起因するが、ヒトの体は約60兆個の細胞からなると考えると、この発がんの確率もゼロにはならない。従って、理論的に変異原性発がん物質に閾値を設定することはできない。しかしながら、極低用量域では高用量域からの一義的外挿では説明できない生物学的反応が効率的に働くため突然変異にも閾値を設定できるとの説もある。ここでの生物学的反応とはDNA修復、代謝反応、スカベンジャーなどの防御機構が考えられる。しかしながら、このような防御機構は突然変異の発生確率の低減化には寄与するが、閾値を作る根拠にはならない。DNA付加体の除去には塩基除去修復機構が働き、これは一般にエラー非発生型の修復機構であるが、10-6以下の発生頻度でエラーが起き、突然変異を引き起こす。同様に、化学物質の無毒化に働く薬物代謝や、スカベンジャーも100%の効率で働くという保証はない。このような科学的・理論的解釈では閾値を設定できないが、現実的には極低用量の遺伝毒性反応は、自然に起きる反応と区別をすることが困難であり、閾値と見なしてもいいのではないかという考え方もある。一般に自然突然変異頻度は10-6程度であり、一定のばらつきをもつ。この原因として、酸化ストレス、老化等の内的要因や、環境中に極微量存在する試験物質以外の化学物質や放射線、紫外線などの影響が考えられる。これにより、自然に起きる遺伝毒性反応内に収まるようなレベルを「現実的閾値(practical もしくは pragmatic threshold)」とするものである。しかし、これは閾値の問題でなく、そのわずかな増加を無視するか否かの問題である。従って、発がん物質が、変異原性試験陽性を示し、特にそれが発がん標的組織であれば、その発がん性に閾値はなく、ADIのような絶対安全量を設定することはできないとすることが妥当である(文献40)
2014年のICH会議で「潜在的発がんリスクを低減するための医薬品中DNA 反応性(変異原性)不純物の評価及び管理ガイドライン;ICH-M7」が制定されたが、このガイドラインの一般原則は「非変異原性である遺伝毒性物質の作用機序は、通常は閾値を有しており、不純物として一般に存在しているレベルではヒトに発がんリスクをもたらすことはない」としている(文献35)。この原則は、変異原性試験であるエームス試験陽性の場合にはその物質閾値が設定できないが、コメット試験、染色体異常試、小核試験等が陽性の場合はエームス試験が陽性でない限り、閾値が設定できることを示している。これにより、エームス試験(遺伝子突然変異試験)以外の遺伝毒性試験には閾値が設定できることがコンセンサスとなった。この考えは医薬品中に微量に存在する不純物だけでなく、食品添加物や残留農薬等の食品中に微量に存在する化学物質等にも適用可能で有り、今後のそれら物質のリスク評価に大きなインパクトを与えるものと考えられる。
4.3. 遺伝毒性発がん物質のリスク管理
それでは、遺伝毒性発がん物質に閾値が設定できなければそのリスク管理はできないのであろうか?米国においては1958年に「発がん性の可能性がある化学物質はいかなる低用量でも安全とみなすことはできない」という、いわゆるデラニー条項により、動物に対して発がん性を示す農薬が残留する加工食品の販売が禁止され、その後、適用範囲が着色料、動物用薬品、飼料に拡大された。しかしながら、このゼロリスク思想は現実的には多くの矛盾点があった。主な矛盾点としては、①分析技術の進歩により、微量な化学物質も検出可能となり、検出限界である安全レベルがどんどん低くなってしまうこと。②発がん性の有無だけが強調されているため、他の毒性が低くて、安全性の高い化合物ができても、わずかの発がん性のため代替できないこと。③人工化学物質のみを対象としているため、天然由来の発がん物質は無視されていること。④動物実験の発がん性試験は、必ずしも人に対する発がん性と一致しないこと、などが挙げられる。これらのことから、1996年「食品品質保護法」の制定とともにデラニー条項は廃止された(食品添加物を除く)。閾値を設定し、ゼロリスクを追求するのに対して、「発がん可能性がある化学物質が充分に低濃度であれば、その発がん可能性は極めて小さくなり、その程度が社会的に許容できるリスクレベルであれば実質的に安全と見なし得る」とのリスク管理の方法もある。この量を実質安全性量(Virtually Safety Dose: VSD)といい、そのリスクレベルを「無視しうる(Negligible)」、もしくは「許容できる(Acceptable)」リスクとする。 ここでの許容できるリスクとしてのがんの生涯リスクレベルは一般的に百万分の1(10-6)が採用されている。10-6の生涯リスクとは日本の人口(108)と、平均寿命(80)から計算すると(108 X 1/80 X 10-6 = 1.25)1年間に1.25人のがんによる死者が増えることを意味する。がんは今や先進諸国では死亡原因の1位であり、我が国においても年間約35万人が、がんで死亡していることを考慮すると1.25人の増加は社会的に許容できると言えよう。VSDは一般に齧歯類を用いた発がん試験で得られた半数がん誘発用量(TD50)からマルチステージモデル、もしくは直線外挿により得られる(図8)。このような発がん化学物質を生涯発がんリスクレベルで評価し、管理に用いる手法は、現在、水道水や大気中に含まれる汚染物質の新しい環境基準値の設定に用いられている。
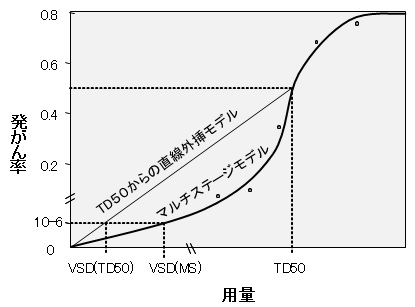
図8.Virtually Safety Dose(VSD) の算出法
Cheesemanらは約500種類の発がん化学物質に関する動物実験でのTD50からVSDを算出し、その算定暴露分布の結果から、ほとんどの発がん化学物質については0.5ug/kg(0.5ppb)以下の食事中濃度で百万分の1のがん生涯リスクよりも低くなることを示した(文献41)。一人の1日食事量を3kg(固形食品1.5kg、飲料1.5kg)とし、その化学物質が全食事にむらなく入っていると仮定すると、1日暴露量は1.5 ug/人と計算できる。つまり、大部分の化学物質については一日の摂取量が1.5ug/人以下であれば、たとえそれが発がん物質であっても実質的な健康危害はほとんどないだろうとすることができる。このような包括的な閾値を「毒性学的懸念の閾値 (Threshold of Toxicological Concern; TTC)」という。TTCは化学構造を考慮すればその毒性がわかっていないものも含め多くの化学物質に適用できる。我が国では食品衛生法に基づき残留農薬のポジティブリスト制が導入されたが、ここでは残留基準値が設定されていない農薬に関しては一律基準値として0.01ppmが設定された。この値もTTC (1.5ug/人)に基づくものであり、個々の農畜産物の一日摂取量はお米を除いて150gを超えることがないという国民栄養調査から計算されている(1.5 /150 = 0.01)。TTCはすでに米国FDAがプラスチック容器から溶出する化学物質(間接添加物)のリスク管理に用いており、またJECFA (FAO/WHO合同食品添加物専門家委員会)は食品に添加する香料物質に適用している。
しかしながら、TTCレベルはその発がん物質に遺伝毒性があった場合にはより慎重な取り扱いが必要となる。Kroesらは600以上の発がん化学物質を比較して、TTCを1.5μg/人とした場合、遺伝毒性、もしくは要注意構造をもつ遺伝毒性物質の幾つかについて高い発がんリスクを懸念している(文献42)。このため、多くの専門家は食事中に低レベルで存在する遺伝毒性/要注意構造をもつ発がん物質に関してはTTCを一桁低い0.15ug/人とすることを推奨している。さらに、TTCが適応できないような極めて強力な遺伝毒性発がん物質としてアフラトキシン類、アゾキシ化合物、ニトロソ化合物を挙げている。これら化合物に関しては個別の毒性データとリスク管理が必要であり、TTCを適用すべきではない。
一方、医薬品に関しては、先の述べたICH-M7ガイドラインで、医薬品中の変異原性不純物の管理に対しては、医薬品のベネフィットを考慮した10-5のリスクレベルを考慮した1.5 μg/人のTTCが採用されている。さらに医薬品は食事と異なり、摂取(服用)期間が限られていることから服用期間を考慮したTTCレベルの緩和(Less than life time TTC)や、化学構造情報から低発がん性を考慮したTTCレベルの緩和(Compound specific TTC)などの現実的なリスク管理手法が取り入れられている(文献43)。
4.4. 遺伝毒性の定量的評価
発がん性のVSDに対して、遺伝毒性についてもVSDを計算し、発がんリスクを評価する方法が検討されている(文献44,45)。これは、発がん性物質について、十分な発がん性試験データがない場合に遺伝毒性試験結果から発がん性リスクを評価する場合に有用である。遺伝毒性エンドポイントとしてはin vivo変異原性試験であるTGR試験が通常用いられる。TGR試験の用量-反応評価結果を基にヒトでの通常の摂取量領域における健康影響評価基準値を設定する際の毒性反応曲線の出発点(Point of Departure; POD)を求める。通常BMDL(benchmark dose lower confidence limit)として計算され、変異原性発がん性物質に関しては発現頻度10%時の信頼下限値であるBMDL10が利用される。BMDL10は 米国EPAが開発したBMDSや、オランダのRIVMが開発したPROAST などで計算することができる。BMDL10は、閾値が設定可能な発がん物質のNOAEL(no observed adverse effect level)に相当し、これを基に安全係数を考慮し、VSDを求めることができる。しかしながら、TGR試験のVSDからヒトへの発がん性リスクを評価し、変異原性発がん性物質を管理するためにはまだ議論とデータが必要である。特に、TGR試験と発がん試験のエンドポイントと投与期間のギャップを埋めるためには適切な安全係数の設定が重要である。しかしながら、将来、十分な科学的根拠が示されれば、TGR試験は発がん性試験に取って代わる日が近い将来来るかもしれない。
5. 遺伝毒性研究・遺伝毒性試験の将来
代表的な遺伝毒性試験であるエームス試験は1970年代に、カリフォルニア大学のBruce Ames博士によって開発された。ほ乳類細胞を用いた染色体異常試験、遺伝子突然変異試験、げっ歯類を用いるin vivo小核試験もほぼ同年代に開発されている。これら試験は30年以上にわたって医薬品、農薬、食品添加物、一般化学物質の安全性評価に利用されその信頼性は高い。一方、これら試験結果データの蓄積は、化学構造の特徴から試験結果を予測する構造活性相関(QSAR)への研究に受け継がれている(文献46)。遺伝毒性は基本的にDNAと化学物質の求電子反応に基づくものであり、化学構造から遺伝毒性を予測することは他の毒性に比べて困難ではない。エ-ムス試験に関する化学物質のデータベースは全世界で2万近くあり、このデータベースからなるQSARモデルは、約90%の精度で試験結果を予測することができる。これは他の遺伝毒性試験についても同様で有り、さらにAI(Artificial Intelligence)技術の進歩も予測性を加速させ、近い将来定型的な遺伝毒性試験は無くなり、全てコンピュータ上で予測・評価される時代が必ず来る。
これまでの遺伝毒性試験では検出が困難である新たな遺伝毒性の脅威にも目を向ける必要がある。ナノ物質や、バイオテクノロジー産物はこれまでに我々が経験したことがない新たな遺伝毒性の脅威になりうる(文献47)。また、遺伝子治療、再生医療などの最新医療の普及に伴う生物製品の安全性についても、試験法、評価法の確立が必要と思われる。
発がんメカニズムとして、近年エピジェネティクスの関与が示唆されている(文献48)。化学物質の中にはDNAの一次構造の変化でなく、DNA のメチル化、アセチル化などの修飾またはマイクロRNAによりDNA産物の発現に影響を与え、発がんに関与するものがある。これらエピ変異原性物質の検出法の開発は始まったばかりである(文献49)。遺伝毒性がもたらすがんや遺伝病以外の疾患にも目を向ける必要がある。最近では、体細胞におけるDNA損傷の蓄積は、早期老化、免疫機能障害、心血管系および神経変性疾患に、生殖細胞におけるDNA損傷の蓄積は、自然流産、不妊等に関連することが報告されている(文献50)。また、最近ではDNA損傷と免疫との関係も注目されている(文献51)。
新たな技術としては、マススペクトルメトリーによるDNAアダクト解析、iPS細胞、次世代型DNAシークエンサー、ハイスループットスクリーニング、ゲノム編集技術、ターゲットミュータジェネシス、各種オミクス技術等が期待される。遺伝毒性の本質的な原因は化学物質にあるのではなく、化学物質が形成するDNAアダクト(DNA損傷)にある。DNAアダクトを網羅的に定性・定量解析できれば、それだけで十分に遺伝毒性の評価が可能になるかもしれない。ヒトiPS細胞などを利用した簡便なin vitro の代替評価系は、ヒトでの安全性を評価する理想的な動物試験代替試験と言える。また、DNAシークエンス技術の高速効率化や、オミクス技術による遺伝子やタンパク質の発現情報は遺伝毒性の発現メカニズムを明らかにし、個人レベルでの発がんリスク評価を可能にし、これら情報の蓄積は、in silicoでの予測へと繋がる。ゲノム編集、ターゲットミュータジェネシスの技術は、がんや遺伝病のモデル細胞や、モデル動物の創出、DNA修復機構解明に大きく貢献できることが期待される。
6. おわりに
1960年の高度経済成長期の日本は、急速な工業化により環境は悪化し、人々は環境汚染物質に曝露され、深刻な公害問題を引き起こした。また、増え続ける人口に対応するため、食料の増産が必須で有り、大量の農薬、食品添加物が使われていた。このような環境中、食品中の化学物質の中には、DNAに損傷を与え、がんや遺伝病を引き起こす化学物質が存在し、それを変異原性物質と言う。国立医薬品食品衛生研究所・変異遺伝部は1978年にその当時食品添加物であったAF-2の発がん性をスクリーニングする方法として変異原性試験が利用され、変異原性研究の重要性が認識されたことを契機として設立された(設立当時、変異原性部)。その後約40年、当部の先人の諸先生が中心となり、我が国の変異原性研究を牽引してきた。研究の成果は、化審法、安衛法、食品衛生法などの法律に反映され、今日の日本では環境や食品を介しての変異原性物質の摂取による健康被害はほぼゼロになるように厳しく規制されている。これはまさにレギュラトリーサイエンスの勝利の結果である。レギュラトリーサイエンスとは、生活環境中に存在する化学物質に関して、その成因や機構、量的と質的な実態、およびその有害性影響をより的確に知るための方法を編み出し、その成果を用いて安全性を予測・評価し、行政を通じて国民の健康に資することである。変異遺伝部は、産・学の研究者との連携により、レギュラトリーサイエンスを介して社会に貢献してきた。
基礎研究の分野においても変異遺伝部の研究は国際的にも高く評価されている。エームス試験、染色体異常試験、小核試験、in vitro 、およびin vivo遺伝子突然変異試験等の標準的遺伝毒性試験法の開発・改良や、変異原性発現機構やDNA修復メカニズムの研究、最近ではエピ変異原、全ゲノム解析、ゲノム編集、QSAR等の新たな研究分野も含め、これまで900報以上の論文を発表してきた。また、歴代の部長は日本環境変異原学会の会長を努め、日本の環境変異原研究の中心的役割を担ってきた。現在では、変異遺伝部は日本環境変異原学会の唯一無二の存在となっている。このように変異遺伝部はレギュラトリーサイエンスと基礎研究を通じて、健康に重大な影響を及ぼす変異原性物質をほぼ征服し、学会においても確固たる地位を築いた。設立から約40年経過した現在、一つの時代が終わったと言っていいかもしれない。
次の時代、変異遺伝部は何をすべきか?遺伝毒性研究において何をすべきか?これ全ての研究部、研究分野に共通する大きな課題である。これまでの手法や、考えにこだわらず、分野を超えて新しいことにチャレンジする必要がある。先ほど重要な変異原物質をほぼ征服したと言ったのは単なるうぬぼれかもしれない。新たな変異原物質は、もしかすると我々の身の回りにまだ多く存在し、ただ、それは従来の方法では見えないだけなのかもしれない。従来の方法にこだわり、新たな脅威を見逃してはなりません。このためにはより高度な戦略が必要だ。今後の変異遺伝部の環境変異原性、遺伝毒性研究に期待する。
令和元年8月寄稿
文献
- OECD(2016): Overview of the set of OECD Genetic Toxicology Test Guidelines and updates performed in 2014-2015 https://dx.doi.org/10.1787/9789264274761-en
- Friedberg, E.C. et al. (2006): DNA Repair and Mutagenesis, 2nd edition:ASM Press, Washington D.C.
- Lindahl, T. (2000): Mutat. Res., 462, 129-135.
- Evan, G, and Littlewood, T. (1998): Science, 281, 1317-1322.
- Cressey, D. (2015): Nature, 526, 307-308.
- Honma, M. (2005): Environ. Mol. Mutagen., 45, 162-176.
- Stephens, P.J. et al. (2011): Cell, 144-27-40.
- Tubio, J.M.C. and Estvill, X. (2011): Nature, 470, 476-477.
- Sakofsky, C.J et al (2014): Cell Rep., 7, 1640-1648.
- Zhang, C.Z. et al. (2015): Nature, 522, 179-184.
- OECD (2010): OECD Guideline for Testing of Chemicals, Full List of Test Guidelines, https://www.nihs.go.jp/hse/chem-info/oecdindex.html
- 石館基 編 (1991): 変異原性,遺伝毒性(毒性試験講座 12),地人書館.
- 石館基 編 (1991): 医薬品の変異原性・遺伝毒性(続医薬品の開発11),廣川書店.
- 労働省化学物質調査課 編 (1991): 労衛法における変異原性試験─テストガイドラインとGLP.中央労働災害防止協会.
- ICH (2011): S2(R1), Guidance on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended for Human Use, https://www.ich.org/products/guidelines/safety/article/safety-guidelines.html
- Maron, D.M. and Ames, B.N. (1983): Mutat. Res., 113, 173-215.
- Mortelmans, K. and Zeiger, E. (2000): Mutat. Res., 455, 29-60.
- Mortelmans, K. and Riccio, E. (2000): Mutat. Res., 455, 61-19.
- OECD (2015): Test No. 490, In Vitro Mammalian Cell Gene Mutation Tests Using the Thymidine Kinase Gene, https://www.oecd-ilibrary.org/environment/test-no-490-in-vitro-mammalian-cell-gene-mutation-tests-using-the-thymidine-kinase-gene_9789264242241-en
- Honma, M. and Hayashi, M. (2011): Environ. Mol. Mutat., 52, 373-384.
- 祖父尼俊雄 (2005): 染色体異常試験―メカニズムから試験法,国際標準化法まで,サイエンティスト社.
- Matsushima, T. et al., (1999): Mutagenesis, 14, 569-580
- Kirsch-Volders, M. et al., (2003): Mutat. Res., 540, 153-163.
- 林真 (1990): 小核試験,サイエンティスト社
- Dertinger, S.D. et al. (2011): Mutagenesis, 26, 139-45.
- Styles, J.A. et al. (2001): Cytometry, 44, 153-155.
- Hamada, M. et al. (2015): Mutat. Res. Genet. Tox. Environ. Mutagen., 780-781, 2-17.
- Nohmi, T. et al. (2000): Mutat. Res., 455, 191-215.
- Thybaud, V. et al. (2003): Mutat. Res., 540, 141-151.
- Tice, R.R. et al. (2000): Environ. Mol. Mutagen., 35, 206-221.
- JaCVAM (2009): The protocol of an international validation study on the in vivo rodent alkaline Comet assay, http://cometassay.com/JaCVAM.pdf
- Miura, D. et al. (2008): Environ. Mol. Mutagen., 49, 622-630.
- https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Multidisciplinary/M7/M7_R1_Addendum_Step_4_2017_0331.pdf
- Miller, A. and Miller, E. C. (1977): Ultimate chemical carcinogen as reactive mutagenic electorophiles. In Hiatt, H. H., Watson, J. D. and Winsten, J. A. (eds.), Origin of Human Cancer. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.
- Ashby, J. (1991): Mutat. Res., 248, 221–231.
- Kirkland, D. et al. (2005): Mutat. Res., 584, 1-256.
- Scott, D. and Roberts, S. (1987): Mutat. Res., 189, 47-58.
- Suter, W. et al. (2002): Mutat. Res., 518, 181-194.
- Jin, M. et al. (2013): Tox. Sci., 131, 387-394.
- Honma, M. (2016): Thresholds of Toxicological Concern for Genotoxic Impurities in Pharmaceuticals. In Nohmi, T. and Fukushima, S. (eds.) Thresholds of Genotoxic Carcinogens. Academic Press, UK.
- Cheeseman, M.A. et al. (1999): Food Chem. Toxicol., 37, 387-412.
- Kroes, R. et al. (2004): Food Chem. Toxicol., 42, 65-83.
- 本間正充 (2009): ファルマシア 45, 143-148.
- Pottenger, L.H. and Gollapudi, B. B. (2009): Mutat. Res., 678, 148-151.
- Gollapudi, B. B. et al. (2013): Environ. Mol. Mutagen., 54, 8-18.
- 本間正充 (2010): 国立医薬品食品衛生研究所報告, 128, 39-43.
- Pfuhler, S. et al. (2013): Environ. Mol. Mutagen., 54, 229-239.
- Lamparska, K. et al. (2012): Nucleic Acid Res., 40, 9788-9801.
- Sugiyama, K. et al. (2015): Biochem. Biophy. Res. Com., 456, 689–694.
- Hoeijmakers, J.H. (2009): New Engl. J. Med., 361, 1475-1485.
- Mackenzie, K.J. et al (2017): Nature, 548, 461-465.